性质
广而言之,以 SOx 表示的硫氧化物是多种多样的,其中包括 SO、S2O3、SO2、SO 、S O 、SO 2-等。但与大气污染问题相关的主要是 SO 。SO 的一般性质如表 8-15 所示。SO2 分子是角形的 O—S—O,键角为 119.5°,S—O 键长为
143pm。其中硫原子采用不等性 sp2 杂化轨道与两个氧原子各形成一个σ键,
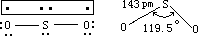 还有一个
p 轨道与两个氧原子相互平行的 p 轨道形成一个П 4 的离域π键,
所以两个 S—O 键具有双键的特征。SO2 分子的结构可表示如下:
还有一个
p 轨道与两个氧原子相互平行的 p 轨道形成一个П 4 的离域π键,
所以两个 S—O 键具有双键的特征。SO2 分子的结构可表示如下:
表 8 — 15 二氧化硫的性质
|
外观 |
无色,窒息性臭气 |
沸点(℃) |
-10.02 |
|---|---|---|---|
|
密度(g/L) |
2.927 |
溶解度(20 ℃,g/100ml 水) |
22.8 |
|
临界温度(℃) |
157.5 |
氧化还原性 |
弱氧化性,稍强还原性 |
|
临界压力(MPa) |
7.87 |
毒性 |
强烈刺激呼吸器官 |
|
凝固点(℃) |
-75.48 |
SO2 的大气化学性质已列举在表 8-13 之中。它的最突出的环境特性是它
在大气中的氧化,最终生成硫酸或硫酸盐,是酸雨或化学烟雾的成因之一。SO2 对环境的最大危害也正表现在这些方面。SO2 对于人体的直接危害表现在,对眼、鼻、咽喉、肺等器官有强刺激性;能引起粘膜炎、嗅觉和味觉障害,倦怠无力等慢性疾患。空气中 SO2 浓度达到(0.03~2.7)×10-6(V/V) 时,多数人可感觉到,对人体的大致安全浓度约 5×10-6(V/V)。
对 SO2 危害敏感的植物有菠菜、黄瓜、燕麦等。SO2 能使这些植物叶脉间
缺绿、变白、呈褐色;且幼嫩而完全展开的叶片更易受害,供水紧缺状态下受害程度较小。对 SO2 危害有较强抵抗能力的有玉米、芹菜、柑桔等。
大气中的 SO2 对金属、涂料、纤维、皮革、纸张、建筑材料等都有不同程度损害作用,主要是通过空气中水分作媒体,经生成 H2SO4 后引起的。例如含大理石、石灰岩等碳酸盐的建筑材料,通过下列反应受到损害:
CaCO3+H2SO4→CaSO4+CO2+H2O
