(五)有机分子和反应的立体化学
1968 年 11 月,生于澳洲的有机化学家康福斯 ( Sir John WarcupCornforth,1917—)在一次演讲的结论中说:“有机化学家常常以为:分子的不对称性,多少有点超出他们的研究范围,因此他们常成功地合成一种已消旋的天然物,却未做那常是冗长乏味而又捉摸不定的光学分离工作, 将它改成具有旋光性。或许这也就是何以常有人猜测旋光性是生命一种特性,需要特殊解释的原因。不过事实上分子并不是消旋的;如我们视生命的复制为分子和分子相互反应的结果,那么,生命起源时,或演变时竟是消旋的这种说法,实比我们现在所观察到的各种旋光性更令人难以想象。我们前述的一切研究,目标只有一个,就是要以我们已了解的不对称性作为基础, 由比较而寻找出生物过程中隐藏着的不对称性,以及立体选择性。”
从 20 世纪 50 年代开始,康福斯研究工作的重点转向酶促生物合成研究, 设计了更精巧更灵敏的实验,用 14C 标记乙酸,在老鼠肝脏内进行生物合成胆甾醇 C27H45OH,首次确定了母体乙酸参与反应时的环状结构模式。康福斯在 1968 年讲演时曾这样说,他曾花了好几年的光阴和许多人合作,“想找出
十八个醋酸分子究竟怎样丢掉 6 个羟基 3 个甲基,而连接成一个胆甾醇分子”。这项早年的研究,本来并未怎样涉及立体化学方面,但后来他仔细地研究角鲨烯 C30H50(胆甾醇的一种先导物)时,曾采用同位素标记术,于是, 快到 1959 的时候,康福斯“着了迷似地想要另一种不对称标记术来研究酶的反应”。这次着迷最重要的成果,便是对不对称甲基乙酸的合成与利用。而康福斯的主要科学成就——从甲瓦龙酸生物合成角鲨烯,也正是从此时开始。
在酶催化合成角鲨烯的整个研究过程中,康福斯对其中的立体化学机制倾注了大量精力。刚开始,是 A·G·奥斯通(Ogston)于 1948 年发表的论文激发了他想象的智慧。奥斯通认为:大多数参与生命活动过程的分子包括酶等都是不对称的。酶对化学反应的催化作用是通过把底物结合在酶分子的特殊部位而发生的,并非所有底物都具有化学概念上的不对称性,而是看上去为对称的分子,当面临不对称的酶的时候,就会显示出不对称性能。奥斯通还指出:对于“隐含”不对称性的底物分子,用同位素取代其中的某一个原子,酶将接受被标记的底物,实验者就可以设计某种方法去发现在标记的原子上所发生的变化。康 H 福斯首次把奥斯通的设想付诸实施。合成角鲨烯的起始物甲瓦龙酸有三个亚甲基,在反应过程中,这三个基团都发生了变化。而三个亚甲基中的六个氢原子都“隐含”着立体化学上的不等性(即前手性)。
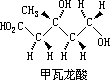
要想造成不对称的甲基,只有把氢的三种同位素——氢、氘、氚各接一个到碳上才行。他设计了非常巧妙的实验,用氢的同位素氘或氚依次标记这些氢原子,在酶制剂的作用下,这些被标记的甲瓦龙酸发生一系列化学反应, 跟踪每一个被标记的氢,就可以知道各个氢原子在反应中所发生的变化,最终就能确定酶促合成角鲨烯过程中各步反应的立体化学行为。从甲瓦龙酸到角鲨烯的生物合成,一共涉及 14 个立体化学控制的反应,在他和波普杰克
(G.Popják)的共同努力下,到 1969 年,除了一个以外,其余 13 个反应的立体化学机制都已搞清,他们也因角鲨烯的生物合成而闻名于世。遗憾的是, 就在此时,波普杰克移居美国,他们的合作中断了。
角鲨烯的生物合成中所剩下的最后一个悬而未决的立体化学问题是:在异戊烯焦磷酸盐异构化变成 3,3—二甲基烯丙基焦磷酸盐的过程中,氢原子从双键的那一面进攻 4—位碳形成甲基。这个问题看上去也许是微不足道的,因为产物的结构不受氢加成方向的影响。但是搞清这个反应机制,能说明许多酶促反应的“隐含”立体化学性质。显然,通过检测该反应的反应物和产物都不能揭示其立体化学机制,而且当时人们尚没有手性甲基的知识, 也没有分析手性甲基的手段。康福斯被这一问题所困扰。后来,德国生物化学家 H·埃格雷尔(Eggerer)关于酶促检定手性乙酸的建议触发了他的灵感。从此,化学与生物学的新合作开始了。康福斯设计了这样的反应:用氢的同位素氚标记异戊烯焦磷酸盐中 4—位碳上的一个氢原子,然后在酶的作用下,在重水介质中对 4—位碳进行加成,经过降解就可以获得手性甲基乙酸。
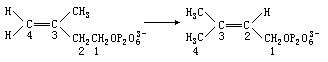
当时尚无法确定手性乙酸的绝对构型。康福斯精心设计了一种立体专一性的合成方法,分别合成了两个互为对映体有确定绝对构型的手性乙酸。与上述酶过程中所获得的手性乙酸对照,进而可以确定该过程中的立体化学机制。最终于 1972 年彻底解决了全部立体化学问题。这种手性甲基方法也可用于探索其它酶过程的立体化学机制。如柠檬酸酯裂解酶把柠檬酸酯裂解为乙酸乙酯,就是用该方法证明的,整个过程都是立体专一性的。

康福斯的这一工作,细致而详尽,开拓了生命过程中酶促反应立体化学机制的研究。他的工作标志着立体化学研究进入生物合成领域的开始,确立了立体化学在酶催化生物合成中的重要地位。由他发展起来的,把有机化学、生物化学与物理技术融合在一起的研究方法,至今仍在世界上广泛用于解决生物合成的机制问题。
由于在研究酶过程中立体化学机理方面的贡献,康福斯与瑞士化学家V·普雷洛格共享 1975 年诺贝尔化学奖。
普雷洛格(Vladimur Prelog,1906—)生于萨拉热窝(现在波黑共和国境内)。由于德国入侵南斯拉夫,1941 年普雷洛格在苏黎世联邦工业学院任教,从 1950 年起他担任该校的化学教授,直到 1976 年退休。
普雷洛格的早期工作对象是生物碱,他的研究解决了金鸡纳树皮生物碱
(抗疟化合物)的构型,校正了马钱子生物碱的分子式,并阐明了其它的如吲哚、甾体和芳香生物碱的构型。后来他研究某些微生物的代谢物,结果他发现了许多新的天然物质,包括发现的第一个天然含硼化合物硼霉素。
普雷洛格深入研究了在中等大小(8—11 节环)的环状结构中构象和化学活性的关系,发现了在这类化合物中可能出现的一种新型反应。普雷洛格接着指出,构象影响着把大小不同的原子或原子团替换到化合物中去的合成结果。根据它出现的规律,使许多重要化合物的构型得到解决。把这项成果应用到酶、辅酶与底物之间的反应中,得到了关于微生物立体专一性的有趣的结论。
与克里斯托弗·英戈尔德(Christopher Ingold)一道,普雷洛格把所谓的 R—S 体系引入有机化学,这第一次使对映体或镜象体能清楚地被描述出来。所谓的 R—S 构型命名原则,即与手性碳原子相连的 4 个基团
*
C abcd,按照各个原子的原子序数排列的优先序列,以a>b>c>d给出各
*
基团的a,b,c,d排列。沿着C− d键,向最小序列d方向看a,b,c排列
的顺序,顺时针方向的称为 R-构型,逆时针方向的称为 S-构型。这一构型命名原则用于表达手性碳原子的构型,不会发生差错,符合系统命名的要求, 已为化学家普遍采用。现在世界上所有从事化学文摘和索引工作的机构都使用 R-S 构型命名原则。此外,他们感到,不对称性和不对称碳等术语虽然一直被有机化学家广泛使用,但是对于它们的准确含义未能引起人们重视,往往引起混乱。他们 3 人于 1966 年发表了一篇文章清楚地阐明了有关立体化学语言的内涵。他们在文中写道:“任何一个分子模型的对称性在于将其进行下述 3 个独立的对称操作以后,都能与其自身完全重合。这 3 个对称操作是:
①围绕着对称轴旋转 2π的约数倍角;②沿着对称面反映;③旋转和反映的组合。只有当分子经过对称操作后无法与其自身重合,这样的分子才没有对称性,只有这样的分子,称之为不对称的,才是正确的。”“不对称性是分子具有光学对映异构体的充分条件,但不是充分必要条件,充分必要条件是分子经过一个面反映以后,所得到的构型不是它自身,也就是其镜象不能仅仅经过平移和旋转操作而与其自身重合。这样的分子模型就具有与反映相关联的两种不同形式,即两种对映异构体,具有手的拓扑学性质。”为了避免混淆,他们建议用手性一词表示分子的与手类似的不重合性质,而不对称性这一术语的用法只限于与上述对称操作的用法相类似。他们的观点为有机化学家广泛接受,从而为立体化学的发展奠定了新的基石。
由于在“有机分子和反应中的立体化学”方面的广泛成果,普雷洛格与约翰·康福斯—道被授予 1975 年诺贝尔化学奖。
