第二阶段:新课的进行
结论(比较发现一)
氧化还原反应的标志:元素化合价变化; 氧化还原反应包括氧化和还原两个半反应; 氧化还原反应的实质:电子转移。
[设问]氧化与还原,化合价升降、电子得失之间有什么联系呢? 结论(比较发现二)
“升失氧”、“降得还”,即化合价升高,失电子,发生氧化反应(被氧化);化合价降低,得电子,发生还原反应(被还原)。
[设问]化合价变化数值与电子得失数目之间有什么定量关系呢?
[板演](准备小黑板,由学生填空)
MnO ( ) → Mn2+
2Cl − ( ) → Cl
CuO( ) → Cu
MnO ( ) → Mn2+ CO( ) → CO2
FeO2 ( ) → 2 Fe
结论(比较发现三)
得电子数=化合价降低值; 失电子数=化合价升高值。
[设问]什么是氧化剂?什么是还原剂? 结论(比较发现四)
氧化剂,得电子,具有氧化性,被还原,发生还原反应,变为还原产物; 还原剂,失电子,具有还原性,被氧化,发生氧化反应,变为氧化产物。第三阶段:新课的延伸
[设问]氧化还原反应中,电子如何转移?怎样表示电子的转移? 结论:电子从还原剂到氧化剂
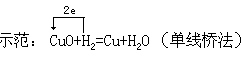
[设问]怎样判断氧化产物、还原产物? 结论(比较发现五)
同一法:氧化剂、氧化产物都具有氧化性,前者氧化性强于后者;还原剂、还原产物都具有还原性,前者还原性强于后者。

氧化剂 还原剂 还原产物 氧化产物第四阶段:新课的巩固(布置作业)
判断下列反应是否是氧化还原反应,若是,用单线桥法表示电子转移, 并指出氧化剂、还原剂、氧化产物、还原产物,哪种元素被氧化,哪种元素被还原?
PCl 3+Cl2 = PCl 5
2 KMnO2 + 16 HCl = 2 KCl + 2 MnCl2 + 5Cl2 ↑ +8 H 2 O MnO2 + HCl ∆ MnCl 2 + Cl2 ↑ + H 2 O
建议:采用本教案设计进行氧化还原反应一节教学时,若教学对象是普通中学的学生,应紧接着安排一节习题课,结合课后习题和参考书的参考题
进行巩固性练习。
(杨明生)
