表 5.4 汽车排气的化学组成
|
项 目 |
空 档 |
加 速 |
定 速 |
减 速 |
|---|---|---|---|---|
|
碳氢化物(乙烷等)(ppm) |
300-1000 |
300-800 |
250-550 |
3000-12000 |
|
乙炔(ppm) |
710 |
170 |
178 |
1096 |
|
醛(ppm) |
15 |
27 |
34 |
199 |
|
氮氧化物(ppm) |
10-50 |
1000-4000 |
1000-3000 |
5-50 一 |
|
氧化碳(%) |
4.9 |
1.8 |
1.7 |
3.4 |
|
二氧化碳(%) |
10.2 |
12.1 |
12.4 |
6.0 |
|
氧(%) |
1.8 |
1.5 |
1.7 |
8.1 |
|
排气量(m3/分) |
0.14 — 0.7 |
1.13 — 5.66 |
0.7 — 1.7 |
0.14 — 0.7 |
|
排气温度(℃) |
149-582 |
482-704 |
427-594 |
204-427 |
|
未燃燃料(%) |
2.88 |
2.12 |
1.95 |
18.0 |
(二)硫化氢和二氧化硫的来源、迁移转化和归宿
硫是组成地球的重要元素之一,在生态循环中起着重要作用。大气中硫
的化合物主要包括:硫化氢(H2S)、二氧化硫(SO2)、三氧化硫(SO3)、硫酸(H2SO4)和硫酸盐及其气溶胶、有机硫及其气溶胶等。硫酸和硫酸盐的干、湿沉降是大气酸沉降的最主要成分。这里主要介绍硫化氢和二氧化硫的来源、迁移转化和归宿。
- 硫化氢(H2S) H2S 主要来自陆地生物源和海洋生物源(表 5.5),
人为来源很少。陆地生态系统产生 H2S 的过程与 CH4 的产生过程类似。如果缺氧土壤中富含硫酸盐,厌氧微生物(还原菌)则将其分解还原成 H2S。土壤中产生的 H2S 一部分重新被氧化成硫酸盐,另一部分被释放到大气中。土壤中 H2S 释放率取决于多种因素,包括土壤中 H2S 产率,氧化率和输送效率。另外,光辐射强度、土壤温度、土壤化学成分和酸度等也都影响着土壤中 H2S 的释放率。
图 5.5 美国曼哈顿交通量与一氧化碳含量的相关关系
由于 H2S 主要来自自然源,它的浓度空间分布变化较大。大气中 H2S 的浓度为 0.05—0.1μg/m3。随高度增加浓度迅速下降。在海洋上空的大气中H2S 的浓度为 0.0076—0.076μg/m3。也就是说,大气中 H2S 的浓度陆地高于海洋,乡村高于城市。H2S 在大气中残留的时间可达 40 天。
H2S 在大气中最终会氧化为 SO2,但其中间转化过程目前还不了解。可能的反应过程是:
H2S+OH→SH+H2O
SH+O2→OH+SO
SO+ 1 O
2
2→SO2
H2S+O→SH+OH H2S+3O→SO2+H2O
H S+ 3 O →SO +H O
2 2 2 2 2
H2S+O2→SO2+H2O
上述反应在气相中进行很慢,但在大气中的颗粒物表面上反应速度则很快。由于 H2S、O2、O3 均溶于水,所以在云雾中反应速度也很快,特别是有过渡金属元素存在时,这种氧化过程进行得更快。
表 5.5 1966 年南、北半球硫的总排出量(106t/a)
|
来 源 |
总 量 |
北半球 |
南半球 |
|---|---|---|---|
|
SO2 |
116 |
136 |
10 |
|
煤 |
102 |
98 |
4 |
|
石油燃烧和制炼 |
28.5 |
27.1 |
1.4 |
|
铜的冶炼 |
12.9 |
8.6 |
4 |
|
铅的冶炼 |
1.5 |
1.2 |
0 |
|
锌的冶炼 |
1.3 |
1.2 |
0.1 |
|
H2S |
107 |
69 |
38 |
|
生物的(陆地) |
72 |
52 |
20 |
|
生物的(海洋) |
32 |
14 |
18 |
|
SO2 污染物来源 |
3 | 3 | 0 |
|
牛皮纸造纸厂 |
0.06 |
0.06 |
0 |
|
海浪飞沫(硫酸盐、亚硫酸盐) |
44 |
19 |
25 |
[注]引自 Robinson 和 Robbins(1969)。
表 5.6 1976 年全球人为排出 SO2 量(1012g/a)(以 S 计)
|
来 源 |
全球排放量 |
占总量百分比(%) |
|---|---|---|
|
煤 |
||
|
无烟煤 |
44.1 |
42.5 |
|
褐煤 |
16.6 |
16.0 |
|
焦煤 |
1.3 |
1.2 |
|
石油 |
||
|
提炼 |
3.7 |
3.5 |
|
汽油 |
0.3 |
0.3 |
|
煤油 |
0.05 |
0.05 |
|
飞机油 |
0.05 |
0.05 |
|
蒸馏燃料油 |
1.9 |
1.8 |
|
残燃料油 |
22.9 |
22.1 |
|
石油炼焦 |
0.3 |
0.3 |
|
非铁矿冶炼 |
||
|
铜 |
9.4 |
9.1 |
|
铅 |
0.8 |
0.7 |
|
锌 |
0.5 |
0.5 |
|
其他 |
||
|
H2SO4 生产 |
1.3 |
1.3 |
|
制浆造纸 |
0.3 |
0.3 |
|
废物焚烧 |
0.3 |
|
|
0.3 |
||
|
生产硫 |
0.03 |
0.03 |
|
—— |
—— |
|
|
总 计 |
103.8 |
100% |
[注]引自 Cullis 和 Hirscher,1980ǎ
- 二氧化硫(SO2) SO2
是大气中分布广、影响大的物质,常用它作为大气污染的主要指标。SO2 来自自然源和人为源。自然源是火山爆发和还原态硫化物(H2S)的氧化;人为源是化石燃料(主要是煤)的燃烧,其次是有色金属冶炼、石油加工和硫酸制备等(表 5.6)。
煤和石油中的硫以无机硫和有机硫两种形式存在,燃烧过程中发生如下
反应。
无机硫绝大部分以硫化金属矿形式存在,燃烧时产生 SO2:
4FeS2+11O2→2Fe2O3+8SO2
有机硫有硫醇、硫醚等,燃烧时先生成 H2S,然后继续氧化为 SO2: CH3CH2CH2CH2SH→H2S+2H2+2C+C2H4
2H2S+3O2→2SO2+2H2O
燃烧过程中生成的 SO2 气体从烟气中排出,少部分生成硫酸盐存在于灰渣中。
SO2 进入大气圈后会发生一系列氧化反应,形成 H2SO4、硫酸盐和有机硫
化合物。目前,一般认为 SO2 的氧化过程有两种途径,即催化氧化和光化学氧化。这两种途径虽不能截然分开但还是有主次之分的。国内外大量研究表明,太阳辐射强度、温度、湿度、气溶胶、云、雾及氧化剂均是影响 SO2 转化的途径和速率的重要因素。
- 二氧化硫的催化氧化 在清洁干燥的大气中,SO2 被缓慢地氧化成
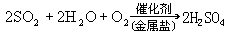 SO3。但在电厂烟气中
SO2 被氧化的速度非常快,其氧化速率是清洁干燥大气的 10—100 倍,这与 SO2
在溶液中有催化剂存在条件下的氧化反应相似,其总反应方程式可表示为:
SO3。但在电厂烟气中
SO2 被氧化的速度非常快,其氧化速率是清洁干燥大气的 10—100 倍,这与 SO2
在溶液中有催化剂存在条件下的氧化反应相似,其总反应方程式可表示为:
在上述反应中,催化剂是指 MnSO4、FeSO4、MnCl4、FeCl2 等金属盐类。催化氧化的基本机理是:由于 Mn、Fe 的硫酸盐和氧化物常常以微粒的形
式悬浮在空气中,当湿度高时,这些颗粒物就成为凝结核与水合成液滴。这
些液滴吸收 SO2 和 O2,并使其在液相中进行一系列化学反应,其具体步骤为:
①气态 SO2 向液滴表面扩散;
②SO2 从液滴表面扩散到内部;
③SO2 在液滴内部发生催化反应。
通常可以认为 SO2 的催化反应为一级反应,其氧化速度与 SO2 的浓度有关,并随催化剂类型与相对湿度而变。
- 二氧化硫的光化学氧化 在低层大气中,SO2 受太阳辐射时被缓慢
地氧化成 SO2。但是,一旦生成 SO2,它便迅速地与大气中的水蒸气反应转变为 H2SO4。如果含有 SO2 的大气中同时存在氮氧化物和碳氢化合物,则 SO2 转化为 SO2 的速度将大大提高,并经常伴随着大量气溶胶的形成。
在大气中只存在 SO2 时,其光化学氧化反应过程如下:大气中 SO2 的吸收光谱表明,在 384nm 处为弱吸收,SO2 吸收此波长的光后转变为三重态 3SO2;
在 294nm 处为强吸收,SO2 吸收此波长的光后转变为单重态 1SO2。也就是当SO2 在大气中吸收不同能量的光波时,形成不同激发态的 SO2:
SO2+hv(340—400nm)→3SO2(第一激发态) SO2+hγ(290—340nm)→1SO2(第二激发态)
3SO2 能量较低,比较稳定。1SO2 能量较高,它在进一步反应中,或者变为基态 SO2,或者变为能量较低的 3SO2。1SO2 遇到第三体 M(O2,N2)时,很快地转变为基态 SO2 或 3SO2,其反应如下:
1SO2+M→SO2+M
1SO2+M→3SO2+M
大气中 SO2 的光化学产物主要是 3SO2,而 1SO2 的作用主要在于生成 3SO2。大气中 SO2 转化为 SO3 主要是 3SO2 与其它分子反应的结果。其中一部分 3SO2 与其它吸收能量的分子反应转化为基态 SO2,其反应如下:
3SO2+M→SO2+M
而当 M 为 O2 时,则:
3SO2+O2→SO3+O
这是大气中 SO2 转化为 SO3 的重要光化学反应过程。在阴天,相对湿度高和颗粒物浓度大的条件下,SO2 的转化途径以催化氧化为主;在晴天,相对湿度低,大气中同时含有氮氧化物和碳氢化合物时,尤其是颗粒物含量很少时, SO2 的转化途径则以光化学氧化为主。SO2 氧化后立即与 H2O 反应,生成 H2SO4。如果大气中还有 NH3 存在时,就会生成(NH4)2SO4。所以,大气中的 SO2 经过一系列的化学转化之后,最终形成硫酸或硫酸盐,然后以湿沉降或干沉降的方式降落到地球表面。
(三)氮氧化物的来源,化学转化及归宿
大气中的氮氧化物主要包括 N2O,NO,N2O3,NO2,N2O5。N2O5 和 N2O5 在大气条件下易分解成 NO 和 NO2,即
N2O3→NO+NO2 N2O5→N2O3+O2
通常把这两种氮氧化物统称为奇氮。NO,NO2 是主要的大气污染物,常用 NOx 表示。
NOx 既有自然来源又有人为来源。自然源主要来自生物圈中氨的氧化、生
物质的燃烧、土壤的排出物、闪电的形成物和平流层进入物。据估计,大气中 NOx 自然源排出量占总量的 47%—54%,人为源排出量占总量的 53%—46
%(表 5.7)。
NOx 人为来源主要指燃料燃烧、工业生产和交通运输等过程排放的 NOx。据统计,1960 年代全世界的 NOx 的年排出量已达 5 千多万吨。
燃料燃烧是指化石燃料燃烧时,排放的废气中含有 NO,其浓度可达千分之几。NO 排入大气后迅速转化为 NO2。
工业生产是指有关企业如硝酸、氮肥和有机合成工业及电镀等工业在生产过程中排出大量 NOx。
交通运输是指机动车辆和飞机等排出废气中含有大量 NOx。汽车排气已成为城市大气中 NOx 的主要来源。
大气中 NOx 的化学转化和归宿是大气环境化学中的一个重要问题。
在最初排放的 NOx 中,NO 占绝对优势,而 NO2 通常只占不到 0.5%。NOx 在光化学烟雾形成过程中,以及 SO2 被氧化过程中都起着重要作用。
表 5.7 大气中 NOx 主要自然源和人为源及其估计排放量 (1983 年)
(单位:106t/a,以 NO2 计)
| 源 |
估计排放量(斯特德曼和谢特资料) |
估计排放量(洛根资料) |
占自然源、人为源排出量/(%)(洛根资料) |
占总量/(%) |
|---|---|---|---|---|
|
一、自然源 |
占自然源排出量 |
|||
|
1.闪电 |
10 |
26 |
27.08-20.63 |
|
|
2.平流层注入 |
3 |
2 |
2.08-1.58 |
|
|
3.氢氧化 |
3 |
3-33 |
3.13-26.19 |
|
|
4.生物质燃烧[包括 |
||||
|
控制燃烧和未控制燃 |
16 |
39 |
40.63 |
30.95 |
|
烧(如森林火灾)] |
||||
|
5.土壤排出 |
33 |
26 |
27.08-20.63 |
|
|
合计 |
65 |
96-126 |
100-99.98 |
47.06-53.85 |
|
二、人为源 |
占人为源排出量 |
|||
|
1.矿物燃料燃烧 |
69 |
63.89 |
||
|
2.生物质燃烧 |
39 |
36.11 |
||
|
合计 |
108 |
100 |
52.94-46.15 |
|
|
总计 |
204-234 |
(资料来源:唐永銮,大气环境化学,1992)
- NO 的主要转化途径 NO 在大气中主要发生以下反应:
2NO+O2→2NO2 NO+O3→NO2+O2 NO+HO2→NO2+OH NO+RO2→RO+NO2 NO+NO2+H2O→2HNO2 HNO2+hv→NO+OH
- NO2 的主要转化途径 NO2 在大气中主要发生以下反应:
NO2+hv→NO+O NO2+OH+M→HNO3+M NO2+RO2+M→RO2NO2(PAN) NO2+RO+M→RONO2 NO2+O3→NO3+O2 NO2+NO3+M→N2O5+M
N2O5+H2O→2HNO3 NH3+HNO3→NH4NO3 2NO2+NaCl→NaNO3+NOCl
NOx 的上述转化过程可由图 5.6 形象地表示出来。
由上述反应可以看出,NOX 的最终归宿是形成硝酸和硝酸盐。大颗粒的硝酸盐可直接沉降到地表和海洋中,小颗粒的硝酸盐被雨水冲刷也沉降到地表和海洋中。
(四)碳氢化合物的来源,转化及归宿由碳元素和氢元素形成的化合物总称为碳氢化合物,一般用 HC 来表示。
图 5.6 奇氮化合物的光化学转化
(据王明星,大气化学,1991)
碳氢化合物主要包括烷烃、烯烃、炔烃、脂环烃和芳香烃。
全世界每年向大气中排放的碳氢化合物约为 1858.3×106t,其中自然排放量占 95%,主要为甲烷和少量萜烯类化合物。人为排放量占世界总排放量的 5%,主要来自汽车尾气、燃料燃烧、有机溶剂的挥发、石油炼制和运输等。全世界碳氢化合物的年排放量见表 5.8。
城市大气中碳氢化合物的人为污染主要来自汽车尾气,即没有完全燃 烧的汽油本身和由于燃烧时汽油裂解或氧化而形成的产物。表 5.9 所列
为汽车尾气中主要成分。
表 5-8 全世界碳氢化合物排出量的估计(60 年代末期)
|
来 源 煤 动 力工业的 家庭和商业的石油 提 炼汽 油煤 油燃料油残余油 挥发和运输损耗天然来源的CH4 稻 田沼 泽 地 潮湿地带其 他 来自植物的萜烯针叶林 阔叶林,耕地和草原胡萝卜素的分解 其 他 溶剂使用焚 烧 炉 木材燃料森林火灾 总 计 |
原料消耗量 |
占碳氢化合物 排出百分数/(%) |
碳氢化合物排出量/(× 106t) |
|---|---|---|---|
|
2.9 |
|||
|
1219 |
0.016 |
0.2 |
|
|
1369 |
0.051 |
0.7 |
|
|
404 |
0.50 |
2.0 石油 |
|
|
11317bbl* |
56t/104bbl |
6.3/ |
|
|
379 |
9.0 |
34 |
|
|
100 |
<.0.1 |
< 0.1 |
|
|
287 |
0.035 |
0.1 |
|
|
507 |
0.039 |
0.2 |
|
|
379 |
2.06 |
7.8 |
|
|
1600 |
|||
|
210 |
|||
|
630 |
|||
|
672 |
|||
|
88 |
|||
|
170 |
|||
|
50 |
|||
|
50 |
|||
|
70 |
|||
|
36.9 |
|||
|
10 |
|||
|
500 |
5.0 |
25 |
|
|
466 |
0.15 |
0.7 |
|
|
324 |
0.37 |
1.2 |
|
|
1858.3 |
[注]引自 Robinson 和 Robbins(1968)。bbl(石油桶)为非法定计量单位,1bbl=158.99dm3
(资料来源:唐永銮,大气环境化学,1992)。
