速率方程
化学反应速率可以用单位时间内反应物浓度的降低或生成物浓度的增加来表示。例如下述反应:
A+B→M+N
则反应速率r,可分别记为 − dcA ,− dc B , dcM 和 dcM
dt dt dt dt 0
如果一个化学反应是基元反应,即反应物分子在碰撞中直接转化为生成物分子,例如基元反应:
则反应速率为:
aA+bB=cM+dN
r = kca ·Cb
A B
即基元反应的速率与反应物浓度的乘积成正比,称为速率方程,其中各浓度项的幂次是反应式中各相应物质的化学计量系数。k 称为该反应的速率常数。
基元反应的这个规律称为质量作用定律。速率常数 k 的大小直接反映了速率的快慢和反应的难易程度。对于同一个反应,速率常数随反应条件(温度、压力、催化剂等)而异。
例如在天然条件下 FeO 氧化为 Fe2O3 的反应,其反应方程式可以写成:
4FeO+O2→2Fe2O3
该式称为 FeO 氧化为 Fe2O3 的总反应,而在不同的天然条件下其反应机制可以有几种:(1)Fe2O3 和中间产物 Fe3O4 同时形成;(2)FeO 在水溶液介质中溶解并形成 FeOHO(氧化),再形成 Fe2O3(脱水)。可见 FeO 的氧化过程可以按照不同的路径进行,即通过不同的基元反应来实现。因此,为了确定总反应的速率必须以反应机制分析为前提,进而根据各基元反应的速率来确定总反应的速率。这里体现了总反应速率的路径相关性。
在理想情况下(即反应机制已知)可以根据各基元反应的速率来确定总反应的速率。如果各基元反应是串联的(即前一个基元反应的生成物是后一个基元反应的反应物),则总反应的速率取决于最慢的一个基元反应;如果基元反应是并联的,则总反应的速率取决于最快的一个基元反应,例如在下面的反应中:
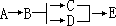
如果路径 A→B→C→E 的速率快于 A→B→D→E,则 A→E 的速率由 A→B→C→ E 来确定,进一步地由该串联机制最慢的步骤控制。
当交代作用发生时,水溶液与固态岩石(矿物)之间氧同位素交换反应决定于反应的动力学过程,因为氧同位素的交换反应受两个并联的过程控制:(1)矿物晶格中氧同位素的扩散;(2)同位素组成在不断变化的原生矿物溶解和重结晶(交代作用)过程。因此氧同位素交换反应的速率由这两个并联过程中的最快者控制,这两个过程的速率大小取决于交换反应发生的条件诸如压力、温度、矿物粒度和晶格类型等。
以上讨论建立在反应机制已知的条件下。当反应机制未知或不能确定时
(即多种可能的路径存在),总反应的速率方程是未知的。此时只能运用实验的方法测定总反应的速率,进而讨论反应机制问题。例如实验测定 FeS 与元素 S 的反应导致黄铁矿形成的速率。实验用非晶质 FeS 与含有元素 S 的H2S 水溶液(水溶液中 S 与 H2S 达平衡)反应,在相同的时间内测定分别采用不同 FeS,S 的初始量和不同 H2S 分压、不同 pH 值条件下 Fe2S 的生成量,可以获得该反应的总速率为:
d( FeS2 )
= kA2
-
A ·p
- (H + )0.1
dt FeS S H2O
式中AFes 和AS 分别为FeS和S的比表面,p H O为H 2S的分压,(H +)为氢
离子浓度。该式表明反应速率依赖于反应物 FeS 的比表面的平方,这将是讨论发生在固体表面的反应速率的重要的结果。
