精细平衡原理及其应用
根据精细平衡原理,在平衡体系中每一个分子过程在正向和逆向上进行的速率平均来说是相等的。这是微观可逆性原理应用于宏观平衡体系的结果,反映了化学平衡是动态平衡的特点。
现讨论如下可逆反应:
当反应达到化学平衡时,各个正向反应与逆向反应的速率相等,根据质量作用定律可得各组分的浓度[ A ], [B] , [C] 与速率常数之间满足:
- ] =
[A]
k1
k −1
[C]
, [B] =
k 2
k −2
- =
[A]
k1k 2
k −1k −3
= k −3 = K k 3

所以平衡时有:
- d[B] = k
dt
1[A] − (k
−1 + k 2
)[B] + k−2
[C] = 0
组份 A 的净消失速率为:
[B] = k1[A] + k −2[C]
k −1 + k 2
- d[A] = k
dt 1
- − k
−1[B]
= k [A] − k k1[A] + k−2[C]
1
= k1k 2
k−1 + k 2
−1
[A] −
k−1 + k2
k−1k−2
k−1 + k 2
[C]
上式的第一项是A→C的反应速率,速率常数为
k1 k 2
k −1 + k 2
,第二项是逆反应C
→A的反应速率,速率常数为
k −1k − 2
k− 1 + k 2
。当体系达到平衡时,正反应和逆反
应的速率常数之比
k1 k2
k −1 k− 2
即为平衡常数。
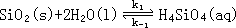 以上讨论表明运用精细平衡原理可以从正向和逆向两方面来推测反应历程,其结果将会更好地与实际相符。此外运用这一原理将动力学与热力学之间直接建立了联系,因此可以根据平衡条件和正向反应速率常数的测定结果来推测逆向反应的速率方程和速率常数。例如通过在实验条件下测定石英的沉淀速率常数
k-1 借助溶解—沉淀反应的平衡常数 K 便可以获得石英的溶解速率常数
k1,反应为:
以上讨论表明运用精细平衡原理可以从正向和逆向两方面来推测反应历程,其结果将会更好地与实际相符。此外运用这一原理将动力学与热力学之间直接建立了联系,因此可以根据平衡条件和正向反应速率常数的测定结果来推测逆向反应的速率方程和速率常数。例如通过在实验条件下测定石英的沉淀速率常数
k-1 借助溶解—沉淀反应的平衡常数 K 便可以获得石英的溶解速率常数
k1,反应为:
例如矿物绿泥石 Mg5Al2Si3O10(OH)8 在颗粒边界水溶液作用下发生进变质作用形成镁铝榴石,反应为:
k 为进变质作用的速率常数。如果镁铝榴石的形成速率为k A [H+ ]2 ( A 为镁
1 V V
[Mg2+ ]2
铝榴石的比表面),根据平衡常数K =
化的速率为
[H+ ]4
,则退变质作用——镁铝榴石
A [Mg 2+ ]2
k−1 V
[ H+ ]2
由此可见天然过程中的沉淀—溶解过程、进变质—退变质过程和交代作用等过程的研究可以借助精神平衡原理由一组自然过程的动力学规律来研究另一组自然过程(逆过程)的动力学规律。
