总复习题
-
二氧化硫分子是由 。
-
硫元素和氧元素组成
-
硫原子和氧原子组成
-
一个硫原子和两个氧原子构成
-
一个硫元素和两个氧元素组成
-
-
同种元素的原子和离子具有相同的 。
-
质子数
-
核外电子总数
-
核外电子层数
-
最外层电子数
- 具有下列质子数的元素中,属于金属元素的是 。
(A)17 (B)13
(C)16 (D)18
- 可以用固体氢氧化钠干燥的气体是 。
(A)二氧化碳 (B)氢气
(C)二氧化硫 (D)氯化氢5.下列说法中正确的是 。
-
水是由氢元素和氧元素组成
-
能电离产生氢离子的物质就是酸
-
核外电子数相同的微粒属于同一种元素
-
含有氧元素的化合物都是氧化物6.下列说法正确的是 。
-
同一种物质的饱和溶液,一定比不饱和溶液含溶质多
-
溶质可以是固体,也可以是气体或液体
-
稀溶液一定是不饱和溶液
-
溶解度曲线不能说明物质溶解性的大小7.下列说法正确的是 。
-
凡能生成盐和水的反应一定是中和反应
-
凡是反应后能生成一种单质和一种化合物的反应都是置换反应
-
中和反应一定是复分解反应
-
凡是物质间交换成分的反应都是复分解反应
- 分离下列混合物时,可按溶解、过滤、蒸发的顺序进行操作的是
。
-
酒精和水
-
食盐和烧碱溶液
-
氯化钾和硝酸纳
-
氯酸钾与二氧化锰的混合物加热完全分解后的产物9.炼铁的原料主要有四种,其中作燃料和还原剂的是
(A)铁矿石 (B)焦炭
(C)石灰石 (D)空气(或富氧空气)
10.在一定条件下,跟 Ca(OH)2,Fe2O3,Fe,AgNO3 四种物质都能反应
的物质是 。
(A)硫酸铜 (B)盐酸
(C)碳酸钠 (D)硝酸11.X,Y,Z 代表三种金属,根据以下条件:
①X+2HCl(稀)=XCl2+H2↑
②Y+2HCl(稀)=YCl2+H2↑
③Z+2HCl(稀)(无反应)
④X+YCl2=XCl2+Y
可判断它们的金属活动性由强到弱的顺序是
(A)X>Z>Y (B)X>Y>Z
(C)Y>X>Z (D)Z>X>Y
- 加热下列物质,生成物中只有碱性氧化物和酸性氧化物的是 。
①MgCO3,②NH4HCO3,③Ca(HCO3)2 溶液,
④CaCO3,⑤Cu(OH)2。
(A)①和② (B)③,④和⑤
(C)④和⑤ (D)①和④
- H2,O2,CO,CO2 四种气体中,密度最大的气体是
;既有可燃性又有还原性的是 ;既可用向上排空气法又可用排水集气法收集的是
;能使澄清石灰水变浑浊的是 。
-
当一氧化碳和二氧化碳的质量比为 时,这两种物质里的氧原子数目相等。
-
将含有 H2,CO,少量 N2,CO2,水蒸气等混合气体依次通过灼热的 CuO,
NaOH 溶液和固体烧碱,最后剩余的气体是 ,以上发生的化学反应方程式是
-
实验室中有下列仪器和试剂:
仪器:酒精灯、量筒、水槽、大试管、长颈漏斗、平底烧瓶、集气瓶。试剂:铜片、锌片、石灰石、碳酸钠、盐酸、氯化钾、氯酸钾、二氧
化锰。
据此,回答下列问题:
-
分别选出实验室制取氢气、氧气、二氧化碳三种气体所用的主要仪器和试剂。
-
如果上述试剂都没有,请你提出适合实验室制取这三种气体的其它代用品,用化学方程式表示出来:
①制 H2:
②制 O2:
③制 CO2:
- 把铜粉、锌粉、氯化铜、碳酸钙、氯化钙各 1
克混合后,加入过量的盐酸并让其充分反应,加水稀释后过滤,用化学式或化学方程式回答:
-
滤纸上残留的物质是 ;
-
反应过程中放出的气体是 ;
-
滤液中的溶质是 ;
-
反应过程有关的化学方程式是
- 写出下列①~⑥步变化的化学方程式:
① ②
③ ④
⑤ ⑥
- 现有两组物质,甲组是:硫酸铜溶液、盐酸、生石灰;乙组是:硫酸钠溶液、苛性钠溶液、硝酸银溶液、水、氢氧化铁。
请从甲、乙组中各选一种物质作为反应物,完成下列指定的反应项目的化学方程式。
反应项目 化学方程式
-
盐和碱反应
-
化合反应
-
酸和盐反应
-
盐和盐反应
- 写出下列各反应的化学方程式
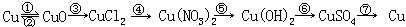
-
指出 CO2,CO,CS2,CH4 等化合物中,碳元素的质量分数从高到低的顺序。
-
某市售尿素肥料[CO(NH2)2]检验结果知其含氮量为 42%,求该化肥
含尿素的质量分数。
-
一定量的锌与氧化锌的混合物,刚好与 73 克 20%的盐酸完全反应,
放出氢气 0.2 克,求混合物中氧化锌的质量分数。
-
现有 K2CO3 与 CaCl2 的混合物 49.8 克,在
40℃的条件下加入一定量的水,搅拌后恰巧完全反应,而且溶液恰为饱和溶液。在该温度下过滤,得滤液 104.3 克,将滤渣洗涤干燥后,称得其质量为 20 克,据此计算:
-
原混合物含 K2CO3 的质量分数;
-
KCl 在 40℃时的溶解度。
25.5.6 克铁恰好跟 200 克稀硫酸完全反应,求反应前硫酸溶液中溶质的质量分数和反应后所得硫酸亚铁溶液中溶质的质量分数。
