参考答案
一、基本操作和基本知识的实验习题
- 要量取 500.0 毫升液体应选用容量瓶,量取 11.1 毫升液体应选用滴定
管,量取 10.0 毫升液体应选用滴定管或移液管,量取 10 毫升液体可以用量筒。这是由仪器的容积、精度决定的。
- 水浴加热法是指用水作传热介质的一种间接加热的方法。这种加热法的主要特点是:加热的温度不会超过
100℃;受热均匀,且温度的升高或降低较缓慢。在测定硝酸钾在水里的溶解度、CCl4 分子量的测定、硝基苯的制取、银镜反应和酚醛树脂的制取等实验中要用到水浴加热法。
3.(1)要把温度计的水银球端悬浮于被量液体的中央,切勿与器壁接触; 当用于分馏(蒸馏)时,水银球上限应和蒸馏瓶支管的下限在同一水平线上。
-
把滤纸放入漏斗时,滤纸角度要与漏斗角度相吻合;滤纸的边缘要低于漏斗口约 5 毫米,然后用水润湿,使滤纸贴紧着漏斗内壁,流进漏斗里的液体的液面要低于滤纸边缘;漏斗下端的管口要紧靠在承受器内壁,把待过滤的液体沿玻璃棒流进漏斗时,烧杯嘴要靠玻棒,玻棒的末端要斜靠在有三层滤纸的一边(一角、二低、三靠)。
-
一般用于分离互不相溶、密度不同的液体,也可做为液、固反应的仪器之一,滴加反应液体或萃取用。
-
使用时,把欲测的溶液用玻棒蘸少量滴在 pH 试纸上,然后把试纸呈现的颜色与标准比色板对照,确定溶液的 pH 值。
-
干燥或吸收某些气体的干燥剂按酸碱性可分为:
酸性干燥剂:浓硫酸、五氧化二磷、硅胶。
碱性干燥剂:石灰、固体氢氧化钠、碱石灰、固体(氢氧化钠和氧化钙的混和物)。
中性干燥剂:无水氯化钙(不能干燥氨气)。
- 装置B 能够用水将氯化氢气体完全吸收,既不会使氯化氢逸出也不会使烧杯中的水倒流入发生器的烧瓶中。装置 A 易使氯化氢气体逸散到空气里去。装置 C 会使水倒流入发生器中,因为氯化氢的溶解度很大。
-
溶解固体物质时,应把固体研细(硝酸盐不能研),以增加接触面, 并用加热(易水解或受热易分解的物质除外)、振荡或搅拌方法加速溶解。溶解气体物质时,为使可溶性气体能比较充分地溶于水,要把导管插入水底, 但对易溶于水的气体,导管口只能靠近水面,不可插入水中,否则水就会立刻从导管倒流入气体发生器里。最好在导管口接一漏斗,漏斗口边缘接触水面以增大接触面。
-
取用液体试剂时,先把瓶塞取下,倒放在桌上,然后用手握住试剂瓶
(瓶上标签应贴着手心,以免药液流下腐蚀标签),使试剂瓶口紧挨着试管口,将试剂慢慢倒入试管,用后随即盖紧瓶塞,并将试剂瓶放回原位(标签向外)。
-
当少量浓酸洒在桌上时,可立即加适量碳酸氢钠溶液,直到不发生气泡为止;如有浓碱洒在桌上,可立即加适量稀醋酸中和。然后用湿抹布擦净, 再用水冲洗抹布。
-
液溴易挥发,碘易升华,它们的蒸气都有毒,应放在磨口玻塞的棕色试剂瓶里。碘用石蜡封口密闭,而溴用石膏封口或水封,存放处要阴凉通风。
-
水冲洗(如沾有浓硫酸应先用布擦去,再用水冲洗),3~5%的碳酸氢钠溶液。水冲洗硼酸溶液。用水冲洗(不可用手擦眼),硼酸溶液冲洗, 水冲洗,要找医生治疗。
-
看清瓶贴上试剂的名称和浓度。取用的量应严格按照实验规定,如果没有明确规定,应取最小量:液体取 1~2 毫升,固体以盖满试管底部为宜。使用浓酸、浓碱,必须特别小心,防止沾到皮肤上或衣服上。
10.(1)取纸条一张折成槽状,将固体粉末放在槽内,平握试管,把纸条伸入管内,到靠近底部时再竖直,让料末落到管底。
-
选取所需长度的玻管一支,用左手拇指平按在切割处,以右手将三角锉刀的锐棱向一个方向拉割几次,使玻管上明显露出痕迹。然后两手平握玻管,用右手拇指放在痕迹下部,左手拇指离痕迹 1 厘米处向下拉折,玻管就沿刻痕断裂。
-
漏斗放在漏斗架上或铁架台的铁圈中;把烧杯放在漏斗下面,烧杯内壁与漏斗颈尖接触;将玻棒和滤纸的三层部分接触;将玻棒沿漏斗中心倾斜;另一烧杯嘴与玻棒接触;滤液比滤纸边缘稍低。
11.(1)氧化铜、锌粒、稀硫酸(6N)。
-
夹紧导管上的橡皮管,若 U 形管的另一管内的稀盐酸上升后不下降,说明装置不漏气。
-
用排水法收集满一试管氢气,管口向下移近酒精灯火焰,如果听到尖锐的爆鸣声,说明氢气不纯,需要再收集,再检验,直到响声很小,才说明氢气已纯净。
-
在干燥试管底部装黑色氧化铜粉末,横夹在铁架台的铁夹上,管口略向下倾。将氢气导管插到氧化铜试管的底部上方,先通氢气片刻,再用酒精灯在氧化铜处加热。反应完成后,停止加热时,仍应通氢气片刻,防止铜再被氧化。
12.(1)粗盐溶解时,用玻棒搅拌是为了加速粗盐溶解。(2)过滤时, 使液体沿玻棒流入过滤器避免液体溅出。(3)蒸发时,不断搅拌液体,以免液体局部过热致使液滴飞溅出来。(4)洗涤固体食盐时,用玻棒把固体移入另一个新做的过滤器里。
-
量瓶上刻度所示的体积是瓶上所标温度下(一般为 20℃)的体积。氢氧化钠溶于水时放出大量的热,所以要待冷却后再注入容量瓶中,否则因体积不准确造成配制溶液的浓度不准。用少量水洗涤两次,并把洗液注入容量瓶中,是为了保证溶液能全部移到容量瓶里。
-
滴定管装溶液前要用少量待装溶液润洗 2~3 次,否则原来管壁上沾有的水分将冲稀待装液的浓度。锥形瓶在装溶液前不要用待测溶液润洗,否则瓶壁上沾有待测溶液,使实际参加反应的待测溶液体积增加。
-
氧气:可用带有火星的木条伸入瓶口约 1 厘米处,如果木条复燃证明收满。
氯气:可用润湿的淀粉碘化钾试纸放在瓶口检验,如果试纸变蓝证明已经收满。
二氧化碳:可用燃着的木条伸入瓶口约 1 厘米处,如果火焰熄灭,证明已经收满。
氯化氢:可用蘸浓氨水的玻璃棒靠近瓶口,如果有白烟产生,证明已经收满。
氨:可用蘸浓盐酸的玻棒靠近瓶口,如果产生白烟,证明已经收满。16.(1)可以用启普发生器装置。(2)不能用。因为这是在加热条件下
固体与固体的反应,应改用试管和带有导管的单孔塞装置。(3)不能用。因是粉末状固体与液体反应,应改用带有滴液漏斗和导管塞子的烧瓶或试管装置。(4)不能用。因是在加热情况下固体与液体的反应,应改用带有滴液漏斗和导管塞子的圆底烧瓶装置。
17.(1)根据它们的沸点不同,用分馏法分离。(2)根据碘在不同溶剂中溶解度的不同,用四氯化碳等有机溶剂进行萃取分液。(3)食盐的溶解度受温度影响不大,用蒸发法提取。
18.干燥剂必须具备不与所干燥的气体发生反应且吸湿性良好性质,所以可以用浓硫酸干燥的是:CO2、H2、CH4、HCl、Cl2。可以用碱石灰干燥的是 H2、CH4、NH3。可以用无水氯化钙干燥的是:CO2、H2、CH4、HCl、Cl2。
19.
|
V 酸读数 |
实验结果 |
|
|---|---|---|
| ( 1 ) |
偏大 |
偏高 |
| ( 2 ) |
偏大 |
偏高 |
| ( 3 ) |
偏小 |
偏低 |
| ( 4 ) |
偏大 |
偏高 |
| ( 5 ) |
偏大 |
偏高 |
20.
|
错误 |
改正 |
|---|---|
|
( 1 )①通入气体的导管没有 |
①把进出气体的导管倒装 |
|
插入溶液中,导出气体的导管插在 |
|
|
溶液里。 |
|
|
②除杂试剂用浓H2SO4 |
②应改用 NaOH 溶液 |
|
错误 |
改正 |
|---|---|
|
( 2 )①试管底部接触酒精灯灯芯 |
①试管应放在酒精灯外焰部分加热 |
|
②试管口向上倾斜 |
②试管口应稍向下倾斜 |
|
③铁夹夹在试管中部 ④用向上排空气法收集 NH3 |
③应夹在离试管口约占试管长 1/3 处 ④改用向下排空气法收集 |
21.需用 m2、m3、T2、P、V。
22.(1)计算:所需纯硫酸的质量是
6× 98 ×
2
250
1000
(克)
98
6× 2
250
× 1000
所需浓硫酸的体积是
1.84×98%
=40.8(毫升)
(2)配制:先在烧杯中加入一定量的蒸馏水(约 70 毫升),用量筒量取所需体积的浓硫酸。将浓硫酸沿玻棒慢慢地倒入蒸馏水中,并不断搅拌。待溶液冷却后,将溶液倒入 250 毫升的容量瓶中,再用少量蒸馏水洗涤烧杯
几次,并将全部洗液倒入容量瓶中。然后向容量瓶内加蒸馏水,当接近刻度线时,再用滴管滴加蒸馏水到刻度线为止。塞上瓶塞,颠倒容量瓶数次,使瓶内的溶液均匀,即得浓度为 6N 的硫酸溶液 250 毫升。
二、物质性质和制备的实验习题 1.(1)装置主要错误有三处:①圆底烧瓶下应加铁圈和石棉网。②装稀
盐酸的广口瓶中进气导管应插入液内,而出气导管应离开液面,管口应在离瓶塞约 1 厘米处。③锥形瓶(产生 H2S 气体反应器)中长颈漏斗应插入液内, 出气导管口应离开液面,离瓶塞约 1 厘米处。
-
吸收混在氯气中的氯化氢气体。
-
有淡黄色固体小颗粒附在集气瓶壁上。
-
蓝色石蕊试纸变红。氯气与硫化氢反应生成的氯化氢气体从导管处逸出遇水生成盐酸。
2.(1)透明无色,生成白色沉淀,
Mg2++2HCO-3+40H-+2Ca2+=Mg(OH)2↓+2CaCO3↓+2H2O
-
深蓝色,有黑色沉淀生成, [Cu(NH3)4]2++S2-=CuS↓+4NH3
-
黄棕,溶液颜色变浅,有淡黄色浑浊现象, 2Fe3++H2S=2Fe2++S↓+2H+
-
透明无色,溶液中出现白色浑浊状态,
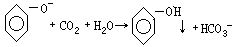
 3.(1)因为盐类水解为吸热反应:
Fe3++3H2O Fe(OH)3+3H+-Q
3.(1)因为盐类水解为吸热反应:
Fe3++3H2O Fe(OH)3+3H+-Q
故温度升高能促进 Fe3+水解,生成氢氧化铁胶体。
-
 预先加入盐酸,可以抑制氯化亚锡水解,防止沉淀形成。Sn2++2H2O
Sn(OH)2+2H+
预先加入盐酸,可以抑制氯化亚锡水解,防止沉淀形成。Sn2++2H2O
Sn(OH)2+2H+ -
由于锌和硫酸铜反应,在锌的表面有铜沉积,锌、铜组成无数的微电池,加快了锌的溶解和氢气产生的速度。
Zn+Cu2+=Zn2++Cu
4.在 NaH2PO4 溶液中,存在以下电离平衡: NaH2PO4=Na++H2PO-4 ①
 H2PO-4
H++HPO2-4 ②
H2PO-4
H++HPO2-4 ②
 HPO2-4
H++PO3-4 ③
HPO2-4
H++PO3-4 ③
溶液中存在有少量 PO3-4,加入 AgNO3 溶液后,发生以下反应: 3Ag++PO43-=Ag3PO4↓
当 Ag3PO4 黄色沉淀生成后。H2PO4-再电离出 PO43-并继续与 Ag+反应,故不断产生黄色 Ag3PO4 沉淀。但是由于溶液中[H-]逐渐增大,抑制了②、③两平衡继续向右移动,Ag3PO4 沉淀不完全。
如果先加入 HNO3,则由于溶液中 H+浓度增大,有利②、③两个电离平衡均向左移动。这时溶液中 PO43-的浓度极小,加入 AgNO3 溶液后,不能看到有 Ag3PO4 沉淀析出。
5.(1)取二支试管,分别注入少量 CuSO4 溶液和 Hg(NO3)2 溶液,再分别投入一小片锌。
第一支试管中的锌片上有红色固体沉积出来:
Zn+CuSO4=ZnSO4+Cu
第二支试管中的锌片上,附着一层黑色物,随着反应进行逐渐显银白色。Zn+Hg(NO3)2=Zn(NO3)2+Hg
(2)取一支试管,注入少量 Hg(NO3)2 溶液,投入一小片紫红色铜片, 不久铜片表面呈银白色。
Cu+Hg(NO3)2=Cu(NO3)2+Hg
从这些置换反应可知它们氧化能力的顺序为: Hg2+>Cu2+>Zn2+ 6.(1)(a)CaCO3;(2)(b)BaSO4;
(3)2I-+Br2=I2+2Br-
7.(a)A 是 NaCl,B 是 HCl,C 是 NH3
-
因为 N 比氢的离子化倾向小,M 比氢的离子化倾向大。
-
二氧化氮。
-
M∶Fe(OH)3 红棕色。N∶[Cu(NH3)4]SO4 深蓝色。
(e)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
8.(1)钠熔成小球,漂游液面,逐渐缩小并放出无色无嗅的气体,溶液中同时生成蓝色沉淀。
2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
- 乳浊液由浑浊变澄清。
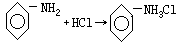
- 试管内出现红棕色气体,但很快消失,同时试管里的水面上升至试管约 2/3
处。
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
9.(1)丙试管中的溶液先出现浑浊,甲试管中的溶液最迟出现浑浊。因为丙试管中 Na2S2O3 溶液浓度最大,甲试管中 Na2S2O3 溶液浓度最小。在其它条件不变情况下,反应速度与反应物浓度成正比,反应物浓度越大,活化分子总数越多,反应速度也越快。
(2)B 试管中溶液最先出现浑浊,A 试管中的溶液最迟出现浑浊。因为在其它条件不变情况下,升高温度,活化分子百分数增大,反应速度随着温度的升高而加快,B 管溶液温度最高,反应速度最快,最先出现浑浊。A 管溶液温度最低,反应速度最慢,溶液最迟出现浑浊。10.(1)①;(2)④;(3)
②;(4)③;(5)⑥;(6)⑦;(7)⑤。三、揭示基本概念和原理的实验习题
- 中和热为 13.6 千卡。
-
减少实验过程中的热量损失。
-
如不盖硬纸板,热量会损失,所得中和热的数值偏低。
-
所放热量不等,因为 60 毫升 1.0 摩/升盐酸跟 50 毫升 1.1 摩/升氢
氧化钠溶液能生成 0.055 摩尔水,而 50 毫升 1.0 摩/升盐酸跟 50 毫升 1.1
摩/升氢氧化钠溶液只能生成 0.05 摩尔水。中和热数值相等,因为“中和热”
的单位是指酸跟碱发生中和反应生成 1 摩尔水时所放出的热量,与酸碱用量无关。
- 因为氨水是弱碱,在中和过程中电离吸热,所以氨水和盐酸的中和热低于氢氧化钠溶液和盐酸的中和热。
- FeCl3 溶液在沸水中,溶液变成红褐色,不再是 FeCl3
溶液,而是带正电荷的 Fe(OH)3,胶粒所组成的胶体溶液,因为 FeCl3 为强酸弱碱盐,能部分水解,而沸水有利于水解反应的进行,结果生成 Fe(OH)3 胶体溶液。
 Fe3++3H2O
Fe(OH)3+3H+
Fe3++3H2O
Fe(OH)3+3H+
这种溶液在 U 形管中,通直流电后,阴极一端颜色变深,表明溶液中带正电荷的红褐色胶粒(即 Fe(OH)3 胶粒)向阴极移动(电泳现象)。往这种溶液中加入电解质(如 Na2SO4)后,有褐色沉淀生成,是由于胶粒所带的正电荷受加入的电解质中带相反电荷的阴离子(如 SO42-)的影响,使胶粒所带的正电荷减少或消失,而发生胶粒的凝聚作用。从上列实验现象可知这种红褐色溶液是 Fe(OH)3 胶体溶液。333
- 阳极,2Cl--2e=Cl2↑,正极。
4.(1)B2++C=B+C2+;(2)A2++B=A+B2+;
(3)A<B<C;A2+>B2+>C2+。5.阳极:4OH--4e=2H2O+O2↑ 阴极:4H++4e=2H2↑
 在两极都产生无色无味的气体,发生电解水的反应。2H2O
2H2↑+O2↑
在两极都产生无色无味的气体,发生电解水的反应。2H2O
2H2↑+O2↑
在两极附近滴入酚酞试液时,阴极附近溶液显红色。
6.(1)甲池:Zn+2Ag+=2Ag↓+Zn2+
(锌极上覆盖一层黑色银粉) 乙池:Zn+2Ag+=2Ag↓+Zn2+
(锌极上覆盖一层黑色银粉) 丙池:Fe+2H+=Fe2++H2↑
(铁片不断溶解:并有无色氢气放出,溶液呈浅绿色)
- ①电子流动方向:电子由甲池的锌极到乙池的银极,然后由乙池的锌极到丙池的铁极,再由丙池的银极流到甲池的银极。
甲、乙两池:
②电极反应式:负极(Zn):Zn—2e=Zn2+
正极(Ag):2Ag++2e=2Ag
丙池:
电极反应式:阳极(Ag):Ag-e=Ag+ 阴极(Fe):2H++2e=H2↑(开始) Ag++e=Ag
- ①电子流动方向:由丙池的铁极到乙池的银极,然后由乙池的另一银极到甲池的银极,再由甲池的另一银极到丙池的银极。
②丙池为原电池。
电极反应式:负极(Fe):Fe-2e=Fe2+
正极(Ag):2H++2e=H2↑ 甲池、乙池为电解池,丙池串联。
电极反应式:阳极(Ag):Ag-e=Ag+
阴极(Ag):Ag++e=Ag
7.(1)①电子由甲池的 Fe 极流向乙池的 Pb 极,再由乙池的 Ag 极流向甲池的 Ag 极。
②电极反应:
甲池:铁极溶解 Fe-2e=Fe2+ 银极上析出铜 Cu2++2e=Cu
乙池:铅极上起初析出铜 Cu2++2e=Cu 时间稍长时会析出银 2Ag++2e=2Ag 银极溶解 2Ag-2e=2Ag+
(2)①电子由乙池中的 Zn 极流向电池中的 Fe 极,再由甲池的 Ag 极流向乙池中的 Ag 极。
②电极反应如下:
乙池:锌极溶解 Zn-2e=Zn2+ 银极上析出铜 Cu2++2e=Cu
甲池:铁极上起初析出铜 Cu2++2e=Cu 时间稍长时会析出银 2Ag++2e=2Ag 银极溶解 2Ag-2e=2Ag+
8.(1)锌棒上看不到变化(或只看到有微量小气泡生成)。Zn+H2SO4=ZnSO4+H2↑
铜棒上无变化。
- 锌极:锌逐渐溶解,发生氧化反应。Zn-2e=Zn2+
铜极:有气泡产生,发生还原反应。2H++2e=H2↑
- 锌极:有气泡产生,发生还原反应。2H++2e=H2↑
铜极:铜逐渐溶解,发生氧化反应。Cu-2e=Cu2+
- 铜极(阴极):有铜析出,发生还原反应。Cu2++2e=Cu
铜极(阳极):铜逐渐溶解,发生氧化反应。Cu-2e=Cu2+
- 铁极:有红色的铜析出,发生还原反应。Cu2++2e=Cu
铜极:铜逐渐溶解,发生氧化反应。Cu-2e=Cu2+
9.(1)此时第(1)部分构成原电池,由于镁的金属活动性比银强,镁是原电池的负极,银是正极。在外电路,电流方向由银向镁,电极反应如下:
正极(Ag):2Ag++2e=2Ag 负极(Mg):Mg-2e=Mg2+
-
此时发生 Ag+被 Fe 置换的反应,铁极上覆盖一层银。Fe+2Ag+=Fe2++2Ag
-
由于镁的金属活动性比银强,第(1)部分构成 Mg-Ag
原电池,成为电源;第(2)部分为电解池,此时发生如下电解反应:
阳极(Ag):Ag-e=Ag+银极溶解阴极(Fe):Ag++e=Ag 铁极镀银
经过一段时间,铁极上覆盖一层银后,切断开关 b,使 a、c 闭合。第(2) 部分银极与镀银的铁极之间电位差为零,此时电路中无电流通过。但如果铁极上所镀的银仍没有把铁完全包住,则仍可构成 Fe-Ag 原电池,此时电路上有电流通过。电极反应如下:
正极(Ag):2Ag++2e=2Ag 负极(Fe):Fe-2e=Fe2+
10.(1)A、B 为原电池串联,锌为负极,铜为正极。
(2)负极(Zn):Zn-2e=Zn2+ 正极(Cu):2H++2e=H2↑
(3)C 为电解池。
阳极(Pt):2Cl--2e=Cl2↑ 阴极(Fe):2H++2e=H2↑
由于 H+在阴极上不断得到电子而生成氢气放出,破坏了附近水的电离平衡,而使阴极附近溶液中 OH-的数目相对地增多,当滴入酚酞试液时,阴极附近溶液变红。
总的化学方程式为
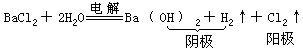
(4)x 极因与原电池负极相连,为挂镀件的阴极,y 极为挂锌板(镀层金属)的阳极,电镀液中必须含有锌离子(镀层金属的离子)。
