四、检验、分离和提纯物质的实验习题
1.根据实验(1),固体混和物溶于水得到无色的溶液,而碳酸钙不溶于水,硫酸铜溶液呈蓝色,所以碳酸钙和硫酸铜一定不存在,根据实验(2), 溶液中加入 BaCl2 溶液,得到白色沉淀,故 Na2SO4 与(NH4)2CO3 可能存在, 因为可能生成BaSO4 和BaCO3 的白色沉淀,根据白色沉淀溶于盐酸,说明Na2SO4 一定不存在,而(NH4)2CO3 一定存在。根据实验(3),溶液的焰色反应呈黄色,说明有 Na+存在,它表明 NaCl 与 NaNO3 中至少存在一种。
2.A 为金属铁粉;B 为无水硫酸铜。有关各步反应方程式为:

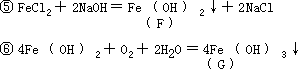

- 根据(1)断定:没有硫化铜、硫酸钡、氯化银和硫化银。根据(2) 可断定:A 中含有 Ag+或 Ba2+中的一种,C 中则含 Ag+或 Ba2+中的另一种,B 中则含有 Na+。有关的离子方程式为:
2Ag++CO32-=Ag2CO3↓ Ba2++CO32-=BaCO3↓
根据(3)可断定:A 中有 Ag+,B 中有 S2-。有关的离子方程式为: Ag++Cl-=AgCl↓
2H++S2-=H2S↑则 C 中必定含 Ba2+。可见 A 为 AgNO3、B 为 Na2S、C 为BaCl2
- 分别取五种需鉴别物质的溶液少许于试管中,然后再各加入少量新制的 Cu(OH)2,观察现象:
-
使 Cu(OH)2 溶解并生成蓝色溶液(CuCl2)的是盐酸。
-
使 Cu(OH)2
溶解并生成绛蓝色溶液的是丙三醇和葡萄糖,无变化的是乙醚和甲醛。
-
加热上面生成的两种绛蓝色溶液,有砖红色沉淀生成的为葡萄糖溶
液,否则为丙三醇。把上面无变化的另两支试管加热,有砖红色沉淀生成的是甲醛溶液,否则是乙醚。
5.(1)A 是 NaHCO3、B 是 Na2CO3,C 是 H2O,D 是 CO2,E 是 CH≡CH。
 (2)①A
受热分解:
(2)①A
受热分解:
2NaHCO3 Na2CO3+H2O+CO2↑
 ②B
溶于水,并水解: Na2CO3+H2O NaHCO3+NaOH
②B
溶于水,并水解: Na2CO3+H2O NaHCO3+NaOH
③B 与 石 灰 水 反 应 : Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
④白色沉淀(CaCO3)遇酸溶解: CaCO3+2HCl=CaCl2+H2O+CO2↑
⑤C 与 电 石 反 应 : 2H2O+CaC2=Ca(OH)2+C2H2↑
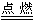 ⑥E
燃烧:
⑥E
燃烧:
2C2H2+5O2 2H2O+4CO2
⑦D 与 石 灰 水 反 应 : CO2+Ca(OH)2=CaCO3↓+H2O
⑧继续加入 D,溶液又变澄清: CaCO3+CO2+H2O=Ca(HCO3)2
 ⑨Ca(HCO3)2
受热分解,溶液又变浑浊: Ca(HCO3)2 CaCO3↓+H2O+CO2↑
⑨Ca(HCO3)2
受热分解,溶液又变浑浊: Ca(HCO3)2 CaCO3↓+H2O+CO2↑
6.(1)各取少量试液分别注入四支试管中,一一滴入适量 NaHCO3 溶液。能生成白色沉淀,同时放出无色无味气体的为 Al2(SO4)3 溶液。能生成白色沉淀但无气泡逸出的为 Ca(OH)2 溶液,能放出无色无嗅气体,但没有沉淀生成的为 CH3COOH 溶液。既没有沉淀生成,也没有气体放出的为 Ba(NO3)2 溶液。
Al3++3HCO3-=Al(OH)3↓+3CO2↑
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O CH3COOH+HCO-3=CH3COO-+H2O+CO2↑
(2)各取少量待检溶液注入四支试管中,分别加入少量新制的 Cu(OH)
2 沉淀,先振荡,后加热。沉淀溶解,生成蓝绿色溶液的是乙酸。振荡,沉淀不溶解,加热后沉淀由蓝色转变成红色的是乙醛。振荡,沉淀不溶解,加热后,沉淀由蓝色转变成黑色的是乙醇
2CH3COOH+Cu(OH)2→Cu(CH3COO)2+2H2O
 CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
 Cu(OH)2
CuO+H2O
Cu(OH)2
CuO+H2O
7.根据各物质的色态和溶解性可首先分为四组:第一组:不溶于水的黑色固体有 FeS,MnO2、CuO;第二组:可溶于水的蓝色固体有 CuSO4·5H2O、Cu(NO3)2·3H2O;第三组:可溶于水的白色固体有 NH4HCO3、Na2CO3、NH4Cl; 第四组:不溶于水的白色固体是 CaCO3 。然后再根据前三组各物质的化学性质进行推断。
第一组:溶于酸,且放出无色刺激性气体,受强热生成红色固体和无色刺激性气体的是 FeS。

第二组:溶于酸,形成蓝绿色溶液,受强热生成黑色固体并放出红棕色气体的应为 Cu(NO3)2·3H2O
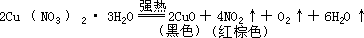
而 CuSO4·5H2O 无此现象。
第三组:溶于酸,且放出无色气体,受强热放出无色刺激性气体的白色可溶性固体应为 NH4HCO3。
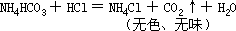

而 Na2CO3 受热不易分解,NH4Cl 溶于盐酸则无气体放出。所以,甲为 FeS,乙为 Cu(NO3)2·3H2O,丙为 NH4HCO3。
8.(1)无水 CaCl2,(2)CS2,(3)CaO,(4)NaOH,(5)HCl,(6) NaHCO3。
9.(1)遇氯气,析出碘。
2KI+Cl2=2KCl+I2 生成的 I2 可用 CCl4 萃取除去。
- 加盐酸(或硝酸),使氧化钙溶解。
CaO+2HCl=CaCl2+H2O 或 CaO+2HNO3=Ca(NO3)2+H2O 过滤,并用蒸馏水洗涤沉淀,得纯净的二氧化硅。
- 将气体通入盛有碱液的洗气瓶中,二氧化碳被吸收除去。
CO2+2NaOH=Na2CO3+H2O
- 将气体通入盛有水或碱液的洗气瓶中,氯化氢气体被水或碱液吸收除去。
10.(1)在用硫酸酸化后的硫酸亚铁溶液中加入纯铁粉,将 Fe3+还原为Fe2+,再进行过滤,除去过量的铁粉,即得纯硫酸亚铁溶液。
Fe+Fe2(SO4)3=3FeSO4
- 在含氯单质的溴水中,加入少量溴化钾,使氯还原为 Cl-。然后蒸馏生成的溴,用水吸收即得纯溴水。
2KBr+Cl2=2KCl+Br2
- 在汞中加入硝酸汞溶液,充分振荡,铜被汞离子(Hg2 +)氧化为Cu2+而进入溶液,弃去上层溶液,即得纯汞。
Hg(NO3)2+Cu=Cu(NO3)2+Hg↓
- 将该气体先通过盛碳酸氢钠溶液的洗气瓶,除掉氯化氢;再通过盛浓硫酸的洗气瓶,除掉水气,这样就得到较纯二氧化碳气体。
NaHCO3+HCl=NaCl+H2O+CO2↑
- 加入氧化钙脱水,滤去固体杂质,经蒸馏就可得到无水乙醇。CaO+H2O=Ca(OH)2
如乙醇的量较少,也可采用加入无水硫酸铜的方法,除去乙醇中所含的水分。
CuSO4+5H2O=CuSO4·5H2O
(周世福)
