废水的处理
污染水体的污染物主要来自城市生活污水、工业废水和径流污水。这些污水若不经处理就排入地面水体,会使河流、湖泊受到严重污染。因此必须先将其输送至污水处理厂进行处理后排放。但这些污水水量非常大,若全部经污水处理厂进行处理,投资极大,因此应尽量减少污水和污物的排放量。如在工业生产中尽可能采用无毒原料,可杜绝有毒废水的产生;若使用有毒原料,则应采用合理的工艺流程和设备,消除逸漏,以减少有毒原料的流失量;重金属废水,放射性废水,无机毒物废水和难以生物降解的有机毒物废水,应与其他量大而污染轻的废水如冷却水等分流;剧毒废水在厂内要进行适当预处理,达到排放标准后才能排入下水道;冷却水等相对清洁的废水, 则在厂内经过简单处理后循环使用。这样既可减少工业废水排放量,减轻污水处理厂的负荷,又可达到废水回用,节省水资源的目的。
排放到污水处理厂的污水及工业废水,可利用多种分离和转化进行无害化处理,其基本方法可分为物理法、化学法、物理化学法和生物法。各种方法的简要基本原理和单元技术列入表 5-1。
表 5 - 1 污水处理方法分类
|
基本方法 |
基本原理 |
单元技术 |
|---|---|---|
|
物理法 |
物理或机械的分离过程 |
过滤,沉淀,离心分离,上浮等 |
|
化学法 |
加入化学物质与污水中有害物质发生化学反应的转化过程 |
中和,氧化,还原,分解,混凝,化学沉淀等 |
|
物理化学法 |
物理化学的分离过程 |
汽提,吹脱,吸附,萃取,离子交换, 电解电渗析,反渗透等 |
|
生物法 |
微生物在污水中对有机物进行氧化,分解的新陈代谢过程 |
活性污泥,生物滤池,生物转盘,氧化塘,厌气消化等 |
废水按水质状况及处理后出水的去向确定其处理程度。废水处理程度可分为一级、二级和三级处理。
一级处理由筛滤、重力沉淀和浮选等物理方法串联组成,主要是用以除去废水中大部分粒径在 0.1mm 以上的大颗粒物质(固体悬浮物),且减轻废水的腐化程度。经一级处理后的废水一般还达不到排放标准,故通常作为预处理阶段,以减轻后续处理工序的负荷和提高处理效果。
二级处理是采用生物处理方法(又称微生物法)及某些化学法,用以去除水中的可降解有机物和部分胶体污染物。
在自然界中,存在大量依靠有机物生存的微生物,它们具有氧化分解有
机物的巨大能力。生物法处理废水就是利用微生物的代谢作用,使废水中的有机污染物氧化降解成无害物质的方法。
二级处理中采用的化学法主要是化学絮凝法(或称混凝法)。废水中的某些污染物常以细小悬浮颗粒或胶体颗粒的形式存在,很难用自然沉降法除去。向废水中投加凝聚剂(混凝剂),使细小悬浮颗粒的胶体颗粒聚集成较粗大的颗粒而沉淀,与水分离。常用的凝聚剂有硫酸铝(Al2(SO4)3),明矾(硫酸铝钾),硫酸亚铁(FeSO4),硫酸铁(Fe2(SO4)3)),三氯化铁
(FeCl3)等无机凝聚剂和多种有机聚合物(高分子)凝聚剂。
经过二级处理后的水一般可达到农灌标准和废水排放标准。但水中还存留一定量的悬浮物、生物不能分解的有机物、溶解性无机物和氮、磷等藻类增殖营养物,并含有病毒和细菌,因而还不能满足较高要求的排放标准,也不能直接用作自来水,要作为某些工业用水和地下水的补给水,则需要继续对水进行三级处理。
三级处理可采用化学法(化学沉淀法、氧化还原法等)、物理化学法(吸附、离子交换、萃取、电渗析、反渗透法等),这是以除去某些特定污染的一种“深度处理”方法。
化学法就是通过化学反应改变废水中污染物的化学性质或物理性质,使之发生化学或物理状态的变化,进而将其从水中除去。例如化学沉淀法,就是利用某些化学物质作沉淀剂,与废水中的污染物(主要是重金属离子)进行化学反应,生成难溶于水的物质沉淀析出,从废水中分离出去。如可用石灰(Ca(OH)2)与废水中 Cd2+,Hg2+等重金属离子形成难溶于水的氢氧化物沉淀:
Cd 2+ + Ca(OH) 2 →Cd(OH) 2 ↓ + Ca 2+
Hg2+ + Ca(OH)2 →Hg(OH) 2 ↓ + Ca 2+
利用沉淀反应除去废水中污染的重金属离子,是水溶液中主要化学反应之一,也是沉淀-溶解平衡的应用。
一个在一定条件下能发生的化学反应体系中,随着反应的进行,反应物浓度逐渐减少,而产物浓度逐渐增加,最终化学反应达到其进行的限度,即达到平衡。不同的化学反应达到平衡态的时间不尽相同,但作为化学平衡态, 都具有共同的特征:
-
平衡建立时反应中各物质的浓度或分压不再随时间而改变,且只要外界条件不变(即温度、压力和浓度等都不变),无论经过多长时间,平衡时各物质的浓度或分压应保持不变,这一特征对实际生产具有重要的指导作用;
-
化学平衡是动态平衡,从宏观上看,化学反应达到平衡态,各物质的浓度或分压不再随时间改变,反应似乎“停止”了,但从微观上看,正逆两方面的反应仍继续进行,只是它们的反应速率相等;
-
化学反应在一定条件下达到平衡态,可用相应的平衡常数描述反应进行的限度。
用石灰与废水中 Cd2+形成难溶物 Cd(OH)2,而难溶物在溶液中总有一定的溶解度,在一定条件下,当溶解与沉淀速率相等时,便建立了固体难溶电解质与溶液中离子间的多相平衡,即:

这个平衡的特点是反应物为 Cd(OH)2 固体,生成物为溶液中的 Cd2+和OH-,其平衡浓度分别用[Cd2+]和[OH-]表示,其平衡常数表达式为:
Ksp=[Cd2+][OH-]2
 当温度一定时,难溶电解质的饱和溶液中,其离子浓度的乘积为一常数,
这个常数叫做溶度积。这个溶度积是饱和溶液中各离子浓度幂的乘积,其中离子浓度与标准浓度比的指数就是溶解平衡方程式中该离子的化学计量数。对于下列难溶电解质溶解平衡通式:AmBn(s)
mAn++nBm-,其溶度积表达式为:
当温度一定时,难溶电解质的饱和溶液中,其离子浓度的乘积为一常数,
这个常数叫做溶度积。这个溶度积是饱和溶液中各离子浓度幂的乘积,其中离子浓度与标准浓度比的指数就是溶解平衡方程式中该离子的化学计量数。对于下列难溶电解质溶解平衡通式:AmBn(s)
mAn++nBm-,其溶度积表达式为:
K = {c / c}m • {c / c}n
书写标准平衡常数表达式必须与相应的化学反应方程式写法相符,标准平衡常数表达式中不考虑反应中出现的纯固体、纯液体和溶剂。平衡常数是化学反应的一个特征常数,其数值大小与各物质的分压或浓度无关,但随反应温度而变,因此写平衡常数时,一般要注明温度,若未注明,通常是指室温(298 K)。
对难溶电解质的溶解平衡,显然 Ksp 越小,其在相同温度下溶解度越小; 反之 Ksp 越大,其溶解度越大。下表列出某些难溶电解质的溶度积。
|
难溶电解质 |
溶度积( Ksp ) |
难溶电解质 |
溶度积( Ksp ) |
|---|---|---|---|
|
Cd ( OH ) 2 |
3 × 10-14 |
CdS |
3.6 × 10-29 |
|
Cu ( OH ) 2 |
5.6 × 10-20 |
CuS |
8.5 × 10-45 |
|
Fe ( OH ) 3 |
1.1 × 10-36 |
FeS |
6 × 10-18 |
|
Hg ( OH ) 2 |
4 × 10-26 |
HgS |
1 × 10-53 |
|
Pb ( OH ) 2 |
1.6 × l0-17 |
PbS |
3.4 × 10-28 |
金属硫化物的溶解度一般都比较小,因此用硫化钠或硫化氢作沉淀剂能更有效地处理含重金属离子的废水,特别是对于经过氢氧化物沉淀法处理后,尚不能达到排放标准的含 Hg2+和 Cd2+的废水,再通过反应生成极难溶于水的硫化物沉淀:
Hg2++S2-—→HgS↓ Cd2++S2-—→CdS↓
这样自然沉降后的出水中,Hg2+ 含量可由起始的 400mg·L-1 左右降至1mg·L-1 以下。
难溶电解质的平衡是一个动态平衡,改变条件可以移动平衡。在实际生产中,可利用同离子效应(在难溶电解质的饱和溶液中,加入含有共同离子的另一电解质,而使难溶电解质溶解度降低的效应),即加入过量的沉淀剂, 就可使沉淀反应趋于完全。这里说的“完全”并非溶液中就不存在欲沉淀分离的离子,一般定性分析中,溶液中该离子浓度不超过 10-5mol·L-1,就可以认为已沉淀完全了。
化学沉淀法处理废水,一般有投药、混合、反应、沉淀等过程。其工艺流程如图 5-1 所示。
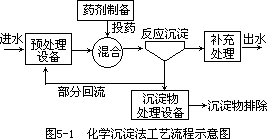
化学氧化法常用来处理工业废水,特别适宜处理难以生物降解的有机物,如大部分农药、染料、酚、氰化物,以及引起色度、臭味的物质。常用的氧化剂有氯类(液态氯、次氯酸钠、漂白粉等)和氧类(空气、臭氧、过氧化氢、高锰酸钾等)。
用氯、次氯酸钠、漂白粉等可以氧化废水中的有机物、某些还原性无机物以及用来杀菌、除臭、脱色等。氯氧化法处理含氰废水是废水处理的一个典型实例。在碱性条件下(pH=8.5~11),液氯可将氰化物氧化成氰酸盐:
CN-+2OH-+Cl2—→CNO-+2Cl-+H2O
氰酸盐的毒性仅为氰化物的千分之一。若投加过量氧化剂,可将氰酸盐进一步氧化为二氧化碳和氮:
2CNO-+4OH-+3Cl2—→2CO2↑+N2↑+6Cl-+2H2O
使水质得以进一步净化。
空气中的氧是最廉价的氧化剂,但氧化能力不够强,只能氧化易于氧化的污染物。过氧化氢(H2O2)具有强氧化能力,适于处理多种含有毒有味化合物及难以处理的有机废水,如含硫、氰、苯酚等的废水。高锰酸钾(KMnO4) 也是强氧化剂,主要用于除去锰、铁和某些有机污染物。
化学还原法主要用于处理含有汞、铬等重金属离子的废水。例如用废铁屑、废铜屑、废锌粒等较汞活泼的金属作还原剂处理含汞废水,将上述金属放在过滤装置中,当废水流过金属滤层时,废水中的 Hg2+即被还原为金属汞:
Fe(Zn,Cu)+Hg2+—→Fe2+(Zn2+,Cu2+)+Hg↓
生成的铁(锌、铜)汞渣经焙烧炉加热,可以回收金属汞。
对于含铬废水,可先用硫酸酸化(pH=3~4),然后加入 5%~10%的硫酸亚铁,使废水中的六价铬还原为三价铬:
6Fe 2+ + Cr O 2− + 14H + —→6Fe 3+ + 2Cr 3+ + 7H O
2 7 2
然后再加入石灰,降低酸度,调至 pH 为 8~9,三价铬离子形成难溶于水的氢氧化铬沉淀,即自然沉降而与水分离。
2Cr3++3Ca(OH)2—→2Cr(OH)3+3Ca2+
物理化学处理法是指运用物理和化学的综合作用使废水得到净化的方法。常用的有吹脱、吸附、萃取、离子交换、电解等方法,有时也归类于化学方法。常用化学方法处理废水的原理和处理对象见表 5-2。
应该指出的是,不同的处理方法有其自身的特点和适应的处理对象,需合理地选择和采用。例如对成分复杂的废水,化学沉淀法往往难于达到排放或回用的要求,则需与其他处理方法联合使用。
表 5 - 2 常用处理废水的化学方法
|
方法 |
原理 |
设备及原材料 |
处理对象 |
|---|---|---|---|
|
混凝 向胶状浑浊液中投加电解质, 凝聚水中胶状物质,使之和水 分开 |
温凝剂有硫酸铝,明矾, 聚合氯化铝,硫酸亚铁, 三氧化铁等 |
含油废水,染色废水,煤气站废水、洗毛废水等 |
|
|
中和 |
酸碱中和, pH 达中性 |
石灰,石灰石,白云石等中和酸性废水, CO2 中和碱性废水 |
硫酸厂废水用石灰中和, 印染废水等 |
|
氧化还原 |
投加氧化(或还原)剂,将废水中物质氧化(或还原)为无害物质 |
氧化剂有空气( O2 ), 漂白粉,氯气,臭氧等 |
含酚,氰化物,硫,铬, 汞废水,印染,医院废水等 |
|
电解 |
在废水中插入电极板,通电后,废水中带电离子变为中性 原子 |
电源,电极板等 |
含铬含氰(电镀)废水, 毛纺废水 |
|
萃取 |
将不溶于水的溶剂投入废水中,使废水中的溶质溶于此溶剂中,然后利用溶剂与水的相 对密度差,将溶剂分离出来 |
萃取剂:醋酸丁酯,苯, N - 503 等 设备有脉冲筛板塔,离心萃取机等 |
含酚废水等 |
|
吸附(包含离子交换) |
将废水通过固体吸附剂,使废水中溶解的有机或无机物吸附在吸附剂上,通过的废水得到处理 |
吸附剂有活性炭,煤渣, 土壤等 吸附塔,再生装置 |
染色、颜料废水,还可吸附酚,汞,铬,氰以及除色,臭,味等用于深度处理 |
