单质碳
碳在周期表里位于第 2 周期ⅣA 族(第 14 例),它有 4 个价电子,电负性中等,它不容易丢失电子成正离子,也不容获得电子成负离子,而容易形成各式各样的共价键。碳单质有 3 种同素异形体。
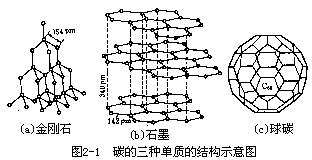
金刚石 碳原子的 4 个价电子,按四面体的 4 个顶点方向和其他 4 个碳原子以 C-C 共价键结合,形成无限的三维骨架,如图 2-1(a)所示。两个碳原子核间距离(即 C-C 键长)为 154 pm(1.54×10-8cm=1.45A0) 。金刚石的三维结构在各个方向都有很高的强度,在天然产物中它的硬度最高, 在单质中它的熔点最高,并且不导电。
石墨 每个碳原子都按平面正三角形方向和其他 3 个碳原子以共价键结合,形成一个六角形平面层。C-C 键长为 142pm,在垂直于层的方向上,还有一个价电子以π键(见第 3 章)的方式将无数的平面层连结在一起,层间距为 340pm,如图 2-1(b)所示。层间价电子活动比较自由,石墨的导电性、滑动性都与此结构状态有关。做铅笔芯的并不是铅而是石墨,但铅笔这个名词已沿用至今。石墨和金刚石都是碳元素的单质,由于结构不同,性质差别很大,但在一定的条件下,石墨可以变为人造金刚石,但变化条件相当苛刻──2000℃以上,1500 MPa。自然界中金刚石储量不多,而新科技对这样坚硬的材料需求日益增长,促使人们进行人造金刚石的研究,并随此发展了高温高压技术。
球碳 1985 年以来化学家和物理学家合作,发现了碳的第 3 种单质-- 球碳②。以石墨棒为电极,在氦气氛中放电,电弧产生的碳原子团沉积在冷却反应器内壁,经分离提纯得到一种由 60 个 C 原子构成的 C60 分子。它的形状很像足球,碳原子位于由 12 个正五边形和 20 个正六边形组成的 60 个顶点处,俗称“足球烯”,如图 2-1(c)所示。C60 的结构,现在已由红外光谱、电子显微镜、X 射线衍射和电子衍射等多种方法测定。而这种结构的初始设
② 顾镇南,张泽莹.固体碳的一种新形态——富勒烯.大学化学,1992(2):
想却是受到美国建筑学家Buckminster Fuller 用五边形和六边形构成球形薄壳建筑结构的启发,因此也有 Fullerball(富勒球)之称。后来还发现了 C50, C70,C84,C120 等各种各样的多面体碳分子,目前对这类物质的研究尚处于开拓阶段。它们有可能做催化剂、润滑剂、超导体等的基质材料。[美]Smalley R E,[美]Curl R F 和[英] Kroto H W,因对开拓这个化学新领域的贡献荣获 1996 年诺贝尔化学奖。