杂化轨道理论
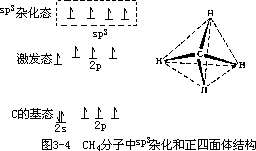
价键理论对共价键的本质和特点做了有力的论证,但它把讨论的基础放在共用一对电子形成一个共价键上,在解释许多分子、原子的价键数目及分子空间结构时却遇到了困难。例如 C 原子的价电子是 2s22p2,按电子排布规律,2 个 s 电子是已配对的,只有 2 个 p 电子未成对,而许多含碳化合物中 C 都呈 4 价而不是 2 价,可以设想有 1 个 s 电子激发到 p 轨道去了。那末 1 个 s 轨道和 3 个 p 轨道都有不成对电子,可以形成 4 个共价键,但 s 和 p 的成键方向和能量应该是不同的。而实验证明:CH4 分子中,4 个 C-H 共价键是完全等同的,键长为 114pm,键角为 109.5°。BCl3,BeCl2,PCl3 等许多分子也都有类似的情况。为了解释这些矛盾,1928 年 Pauling 提出了杂化轨道概念,丰富和发展了的价键理论。他根据量子力学的观点提出:**在同一个原子中,能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道。**参看图 3-4,C 原子中 1 个 2s 电子激发到 2p 后,1 个 2s 轨道和 3 个 2p 轨道重新组合成 4 个、sp3 杂化轨道,它们再和 4 个 H 原子形成 4 个相同的 C-H 键, C 位于正四面体中心,4 个 H 位于四个顶角。
杂化轨道种类很多,如三氯化硼(BCl3)分子中 B 有 sp2 杂化轨道,即
 由
1 个 s 轨道和 2 个 p 轨道组合成 3 个 sp2 杂化轨道,在氯化铍(BeCl2)中有
sp 杂化轨道,在过渡金属化合物中还有 d 轨道参与的 Sp3d 和 sp3d2
杂化轨道等。
由
1 个 s 轨道和 2 个 p 轨道组合成 3 个 sp2 杂化轨道,在氯化铍(BeCl2)中有
sp 杂化轨道,在过渡金属化合物中还有 d 轨道参与的 Sp3d 和 sp3d2
杂化轨道等。
以上几例都是阐明了共价单键的性质,至于乙烯和乙炔分子中的双键和三键的形成,还需要有σ键和π键的概念。两个成键原子核间联线叫键轴, 凡原子轨道沿键轴方向“头碰头”的方式重叠成键,称为σ键,如图 3-5 中(a)和(b)所示。另一种是原子轨
道沿键轴方向“肩碰肩”的方式重叠,称为π键,如图 3-5 中(c)

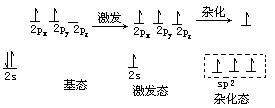 原子的激发态中
2px,2py 和 2s 形成 sp2 杂化轨道,这 3
个轨道能量相等,位于同一平面并互成 120℃夹角,另外一个 pz
轨道未参与杂化,位于与平面垂直的方向上。碳碳双键中的 sp2 杂化如下所示。
原子的激发态中
2px,2py 和 2s 形成 sp2 杂化轨道,这 3
个轨道能量相等,位于同一平面并互成 120℃夹角,另外一个 pz
轨道未参与杂化,位于与平面垂直的方向上。碳碳双键中的 sp2 杂化如下所示。
 这
3 个 sp2 杂化轨道中有 2 个轨道分别与 2 个 H 原子形成σ单键,还有 1 个 sp2
轨道则与另一个 C 的 sp2 轨道形成头对头的σ键,同时位于垂直方向的pz
轨道则以肩并肩的方式形成了π键。也就是说碳碳双键是由一个σ键和一个π键组成。π键原子轨道的重叠程度小于σ键,容易断裂,所以含有双键的烯烃很容易发生加成反应。乙炔分子(C2H2)中有碳碳三键(HC≡CH),
激发态
这
3 个 sp2 杂化轨道中有 2 个轨道分别与 2 个 H 原子形成σ单键,还有 1 个 sp2
轨道则与另一个 C 的 sp2 轨道形成头对头的σ键,同时位于垂直方向的pz
轨道则以肩并肩的方式形成了π键。也就是说碳碳双键是由一个σ键和一个π键组成。π键原子轨道的重叠程度小于σ键,容易断裂,所以含有双键的烯烃很容易发生加成反应。乙炔分子(C2H2)中有碳碳三键(HC≡CH),
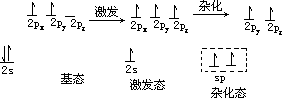
激发态
的 C 原子中 2s 和 2px 轨道形成 sp 杂化轨道。这两个能量相等的 sp 杂化轨道在同一直线上,其中之一与 H 原子形成σ单键,另外一个 sp 杂化轨道形成 C 原子之间的σ键,而未参与杂化的 py 与 px 则垂直于 x 轴并互相垂直,它们以肩并肩的方式与另一个 C 的 py,pz 形成π键。即碳碳**三键是由一个σ键和两个π键组成。**这两个π链轨道重叠也较少,因而容易断开,所以含三键的炔烃也容易发生加成反应。
甲烷、乙烯、乙炔都是最基本的简单有机化合物,以价键理论为基础, 用杂化轨道和σ键π键的概念,很好地解释了它们的结构和性质。
