1.3.2 元素的周期性质
原子核外电子排布具有周期性变化规律,因此与原子结构有关的一些元素性质如电离能、电子亲和能和电负性等也随之呈现显著的周期性。
电离能 气态原子失去一个电子成为一价气态正离子所需吸收的能量称为原子的第一电离能(I1),即
A(g)+I1→A+(g)+e-
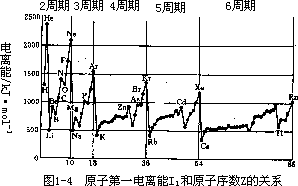
气态一价正离子再去掉一个电子成为二价正离子所需的能量,称为第二电离能 I2,第三和第四电离能可以类推。电离能中第一电离能 I1 最小,也最重要。各元素第一电离能数据列入表 1-6,第一电离能随原子序数 Z 变化的关系示如图 1-4 所示。在 I1-Z 的曲线上,各种稀有气体的电离能处于极大值,而碱金属处于最小值。这是由于稀有气体的原子形成全充满电子层,从全充满电子层上移去一个电子是很困难的,要吸收较多的能量。碱金属价电子层只有一个电子,很容易失去,电离能较小,但若再失去第二个电子就很困难了,所以碱金属容易形成一价正离子。在主族元素表 1-6 元素的第一电
离能
|
H 13.598 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
Li 5.392 |
Be 9.322 |
|||||||
|
Na 5.139 |
Mg 7.646 |
|||||||
|
K 4.341 |
Ca 6.113 |
Sc 6.54 |
Ti 6.82 |
V 6.74 |
Cr 6.766 |
Mn 7.435 |
Fe 7.870 |
Co 7.635 |
|
Rb 4.177 |
Sr 5.695 |
Y 6.38 |
Zr 6.84 |
Nb 6.88 |
Mo 7.099 |
Tc 7.28 |
Ru 7.37 |
Rh 7.46 |
|
Cs 3.894 |
Ba 5.212 |
La 5.577 |
Hf 7.0 |
Ta 7.89 |
W 7.98 |
Re 7.88 |
Os 8.7 |
Ir 9.1 |
|
Fr |
Ra 5.279 |
Ac 6.9 |
I 1
|
He 24.587 |
||||||||
|---|---|---|---|---|---|---|---|---|
|
B 8.298 |
C 11.260 |
N 14.534 |
O 13.618 |
F 17.422 |
Ne 21.564 |
|||
|
Al 5.986 |
Si 8.151 |
P 10.486 |
S 10.360 |
Cl 12.967 |
Ar 15.759 |
|||
|
Ni 7.635 |
Cu 7.726 |
Zn 9.394 |
Ga 5.999 |
Ge 7.899 |
As 9.81 |
Se 9.752 |
Br 11.814 |
Kr 13.999 |
|
Pd 8.34 |
Ag 7.576 |
Cd 8.993 |
In 5.786 |
Sn 7.344 |
Sb 8.641 |
Te 9.009 |
I 10.451 |
Xe 12.130 |
|
Pt 9.0 |
Au 9.225 |
Hg 10.437 |
Tl 6.108 |
Pb 7.416 |
Bi 7.289 |
Po 8.42 |
At |
Rn 10.748 |
 本表数据录自
Robert C. West,”CRC Hardbook of chemistry and Physics”, 63 rd ed.1988—
89,E78—79。表中数据单位为电子伏特(eV),将其乘以
96.4846,所得数据单位即为 kJ·mol-1。
本表数据录自
Robert C. West,”CRC Hardbook of chemistry and Physics”, 63 rd ed.1988—
89,E78—79。表中数据单位为电子伏特(eV),将其乘以
96.4846,所得数据单位即为 kJ·mol-1。
中,同一周期元素的电离能 I1,基本上随着原子序数的增加而增加,例如第三周期 Na,Mg→Cl,Ar 的电离能逐渐增大。而同族元素的电离能随原子序数的增加而减小,如 IA 族的 Li,Na,K,Rb,Cs 的电离能依次减小。因此位于周期表左下角的碱金属铯(Cs)的 I1 最小,最容易失去电子成为正离子, 金属性最强。而位于周期表右上角的稀有气体元素氦(He)的 I1 最大。同一周期中 I1 并非单调的上升,例如 Be,N,Ne 的 I1 都较相邻两元素为高,这是由于它们的原子轨道上的电子填充时出现了全满,全空或半满的情况。致于副族元素,同一周期元素的最外层价电子相同,因而第一电离能差别不大, 也没有明显的规律性。
电子亲和能 气态原子获得一个电子成为一价负离子时所放出的能量,称为电子亲和能(Y),即
A(g)+e-→A-(g)+Y
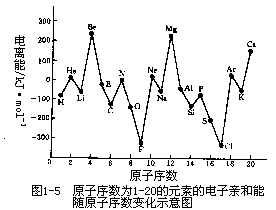
由于电子亲和能的实验测定比较困难,因此数据可靠性较差,数据也不完全。图 1-5 给出了周期表中原子序数为 1~20 的元素电子亲和能随原子序数的周期性变化情况。
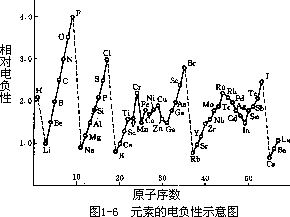
原子的电负性 原子的电负性概念最早由 Pauling L 提出,用以量度分子中原子对成键电子吸引能力的相对大小。原子电负性越大,表明其在 分子中吸引成键电子的能力越大;原子电负性越小,其在分子中吸引成键电子的能力也越小。例如 H 和 Cl 的电负性分别为 2.1 和 3.0,那么在 HCl 分子中 Cl 对成键电子吸引力比 H 大,即成键电子偏向 Cl。各元素电负性数据见表 1-7。原子电负性随原子序数的周期性变化如图 1-6 所示。同一周期元素,由左向右电负性逐渐增大;同一族元素,从上至下电负性逐渐减小。因此电负性大的元素集中在周期表的右上角如 F,C,O,N 等,电负性小的元素位于周期表的左下角如 Cs,Ba,Rb 等。金属元素的电负性较小,非金属元素的电负性较大。电负性是判断元素金属性的重要参数。
表 1-7 元素的电负性 x
|
Li 1.0 |
Be 1.5 |
H |
|||||
|---|---|---|---|---|---|---|---|
|
Na 0.9 |
Mg 1.2 |
2 · 1 |
|||||
|
K 0.8 |
Ca 1.0 |
Sc 1.3 |
Ti 1.5 |
V 1.6 |
Cr 1.6 |
Mn 1.5 |
Fe 1.8 |
|
Rb 0.8 |
Sr 1.0 |
Y 1.2 |
Zr 1.4 |
Nb 1.6 |
Mo 1.8 |
Tc 1.9 |
Ru 2.2 |
|
Cs 0.7 |
Ba 0.9 |
La-Lu 1.0-1.2 |
Hf 1.3 |
Ta 1.5 |
W 1.7 |
Re 1.9 |
Os 2.2 |
|
Fr 0.7 |
Ra 0.9 |
Ac 1.1 |
|
B 2.0 |
C 2.5 |
N 3.0 |
O 3.5 |
F 4.0 |
||||
|---|---|---|---|---|---|---|---|---|
|
Al 1.5 |
Si 1.8 |
P 2.1 |
S 2.5 |
Cl 3.0 |
||||
|
Co 1.9 |
Ni 1.9 |
Cu 1.9 |
Zn 1.6 |
Ga 1.6 |
Ge 1.8 |
As 2.0 |
Se 2.4 |
Br 2.8 |
|
Rh 2.2 |
Pd 2.2 |
Ag 1.9 |
Cd 1.7 |
In 1.7 |
Sn 1.8 |
Sb 1.9 |
Re 2.1 |
I 2.5 |
|
Ir 2.2 |
Pt 2.2 |
Au 2.4 |
Hg 1.9 |
Tl 1.8 |
Pb 1.9 |
Bi 1.9 |
Po 2.0 |
At 2.2 |
 数据摘自L.Pauling
and P.Pauling, “Chemistry”,1975,p.175。
数据摘自L.Pauling
and P.Pauling, “Chemistry”,1975,p.175。
电负性差别大的元素之间化合生成离子键的倾向较强,电负性相同或近似的非金属元素相互以共价键结合。电负性相等或相近的金属元素相互以金属键结合。有关化学键的内容见第 3 章。元素周期律是人们在长期科学实践活动中积累了大量感性资料后总结出来的自然科学规律,它把自然界众多元素看作有内在联系的统一整体。量子力学又从理论上阐明了原子核外电子排布的周期规律性。可以说元素周期律对学习化学知识至关重要,正确运用元素周期律对开展化学研究也是至关重要的。例如在 1987 年发现了钡(Ba)、钇(Y)、铜(Cu)复合氧化物具有高温超导特性,全世界掀起“超导热”,化学家们顺着周期律对ⅡA 族(如Ca,Sr)、ⅢA 族(如 Sc 和 La 系元素)、ⅠB 和ⅡB 族(如 Ag,Au,Zn,Cd) 等各种元素的复合氧化物体系进行了“全面搜索”。也可以说一个多世纪以来化学家们一直在为耕耘周期表而忙碌。
