离子键和离子化合物
氯化钠(NaCl)是最典型的离子化合物,它是食盐的主要成分。它易溶于水,熔点较高(801℃),熔融状态的氯化钠能导电,电解产物是金属钠和氯气:
2NaCl 熔融→2Na + Cl
电解 2
反之,金属钠在氯气中燃烧,Na 和 Cl2 就化合生成 NaCl。那未钠原子和氯原子之间是靠什么样的作用力相结合的呢?从原子核外电子结构看,化学性质很稳定的稀有气体如氦(He)、氖(Ne)、氩(Ar)等亦称惰性气体, 它们的外层电子结构都是 s2p6,也可以说 s2p6(八电子)是一种稳定的电子结构。从附录 1,可知,钠原子和氯原子的核外电子排布分别是:
11Na:
17 Cl:
1s2 2s2 2p6 3s1 1s2 2s2 2p63p5
钠原子失去 3s1 电子而成钠离子 Na+(2),这是稳定的 s2p6 全充满状态。
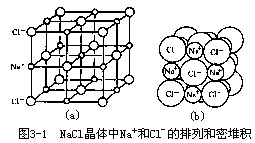
而氯原子获得 1 个电子则成氯离子 Cl-(1s22s22p63s23p6),这也是稳定的s2p6 状态。带正电的 Na+和带负电的 Cl-借静电作用力相结合,这种强烈的静电作用力称为离子键,由离子键结合成的化合物叫离子化合物①,得电子或失电子的数目叫电价数。氯化钠晶体实际上就是这些 Na+和 Cl-相间配置而成,见图 3-1(a)。可以将正负离子近似看成球形,每个离子都尽可能多地吸引异号离子而紧密堆积,见图 3-1(b)。
IA 主族碱金属原子核外层都有 s1 电子,都容易失去一个电子而成+1 价的正离子,而ⅦA 主族卤素原子核外电子结构是 s2p5,它们都容易得到一个电子而成-1 价负离子。所以碱金属和卤素借离子键形成离子化合物,如氯化钾(KCl)、氯化铯(CsCl)、氟化铯 CsF)、溴化钾(KBr)等。随正负离子半径大小不同离子的堆积方式有所差别。如铯原子比钠原子大,所以每个 Cs+的周围可以配置 8 个 Cl,而 1 个 Na+的周围只能配置 6 个 Cl-。
氯化镁的化学式是 MgCl2 而不是 MgCl,氧化镁的化学式不是 MgO2,而是MgO,这从核外电子排布、化学键的价数考虑,都是容易理解的:
12 Mg:
17 Cl:
8 O:
1s2 2s2 2p6 3s2
1s2 2s2 2p6 3s2 3p5
1s2 2s2 2p 4
Mg 失去 2 个 3s 电子,成为 2s22p6 稳定结构,而 O 得 2 个电子,也形成2s22p6 结构,所以 Mg2+和 O2-形成 MgO,而 Cl 得 1 个电子即可形成 3s23p6 结
① 尹炼.能源的地位、问题、对策——对我国新能源战略的评估与对策探讨,科技导报,1993(7):
构,所以 Mg2+可以和 2 个 Cl-化合而成 MgCl2。
原子的电负性表明原子对成键电子吸引能力的大小,参看表 1-7,周期表里位于右上方的非金属电负性较大,位于左下方的金属电负性较小。电负性差别越大的原子间越容易形成离子化合物。如 NaCl,CsCl,CaF2 等都是典型的离子化合物。
正负离子间的静电作用力是很强的,室温下离子化合呈固态,熔点都较高(NaCl 的熔点是 801℃,CsCl 是 646℃,CaF2 是 1360℃)。熔融状态的离子化合物可以导电。
离子键的强度可用晶格能(U)的大小来衡量,晶格能是指 1mol 离子晶体解离成自由气态离子所吸收的能量。如 NaCl 的晶格能为 786kJ·mol-1,即
NaCl(s)→Na(g) + 1 Cl
2 2
(g)
U = 789kJ • mol −1
CsCl 的晶格能为 657kJ·mol-1,CaF2 则是 2609kJ·mol-1。晶格能的大小与正负离子电荷数成正比,与正负离子间的距离成反比。晶格能越大,即正负离子间的结合力越强,所以晶体的熔点就越高,硬度也越大。表 3-1 列举了几种离子晶体中电荷数(z),离子间距离(r0)与晶格能、熔点、硬度的关系。
表 3 - 1 晶格能*与晶体性质
|
离子化合物 |
电荷数 Z |
r0 pm |
晶格能 kJ • mol −1 |
熔点 ℃ |
莫氏硬度 |
|---|---|---|---|---|---|
|
NaF |
1 |
231 |
923 |
993 |
3.2 |
|
NaCl |
1 |
282 |
786 |
801 |
2.5 |
|
MgO |
2 |
210 |
3791 |
2852 |
6.5 |
|
CaO |
2 |
240 |
3401 |
2614 |
4.5 |
*晶格能可以用实验数据间接计算,也可以做理论计算。硬度标准分 10
级,等级越高,表示物质越硬。如金刚石的硬度为 10 级,石英(SiO2)为 7
级,方解石(CaCO3)为 3 级等。
