核外电子排布
多电子原子的核外电子排布可用四个量子数描述,它们遵循以下三条原理。
保里不相容原理 在一个原子中没有两个电子具有完全相同的四个量子数。或者说一个原子轨道上最多只能排两个电子,而且这两个电子自旋方向必须相反。因此一个 s 轨道最多只能有 2 个电子,p 轨道最多可以容纳 6 个电子。按照这个原理,表 1-1 归纳了各个原子轨道上可容纳最多的电子数,从表中可得出第 n 电子层能容纳的电子总数为 2n2 个。
能量最低原理 自然界一个普遍的规律是“能量越低越稳定”。原子中的电子也是如此。在不违反保里原理的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
原子轨道能量的高低(也称能级)主要由主量子数 n 和角量子数 l 决定。当 l 相同时,n 越大,原子轨道能量 E 越高,例如 E1s<E2s<E3s;E2p<E3p
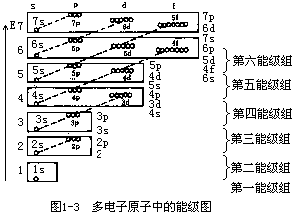
<E4p。当 n 相同时,l 越大,能级也越高,如 E3s<E3p<E3d。当 n 和 l 都不同时,情况比较复杂,必须同时考虑原子核对电子的吸引及电子之间的相互排斥力。由于其他电子的存在往往减弱了原子核对外层电子的吸引力,从而使多电子原子的能级产生交错现象,如 E4s<E3d,E5s<E5s。Pauling 根据光谱实验数据以及理论计算结果,提出了多电子原子轨道的近似能级图,如图1-3 所示。用小圆圈代表原子轨道,按能量高低顺序排列起来,将轨道能量相近的放在同一个方框中组成一个能级组,共有 7 个能级组。电子可按这种能级图从低至高顺序填入。
洪特规则在能量相等的轨道上,自旋平行的电子数目最多
时,原子的能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有 6 个电子,按能量最低原理和保里不相容原理,首先有 2 个电子排布到第一层的 1s 轨道中,另外 2 个电子填入第二层的 2s 轨道中,剩余 2 个电子排布在 2 个 p 轨道上,具有相同的自旋方向, 而不是两个电子集中在一个 p 轨道,自旋方向相反。
作为洪特规则的补充,能量相等的轨道全充满、半充满或全空的状态比较稳定。
根据以上原则,电子在原子轨道中填充排布的顺序为 1s 2s 2p3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d⋯
下面我们运用核外电子排布的三原则来讨论核外电子排布的几个实例。氮(N)原子核外有 7 个电子,根据能量最低原理和保里不相容原理,首
先有 2 个电子排布到第一层的 1s 轨道中,又有 2 个电子排布到第二层的 2s 轨道中。按照洪特规则,余下的 3 个电子将以相同的自旋方式分别排布到 3 个方向不同但能量相同的 2p 轨道中。氮原子的电子排布式为 1s2 2s2 2p2。
这种用量子数 n 和 l 表示的电子排布方式,叫做电子构型或电子组态,右上角的数字是轨道中的电子数目。也可以用下式比较形象地表明这些电子的磁量子数和自旋量子数:
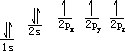
氖(Ne)原子核外有 10 个电子,根据电子排布三原则,第一电子层中有2 个电子排布到 1s 轨道上,第二层中有 8 个电子,其中 2 个排布到 2s 轨道上,6 个排布到 2p 轨道上。因此氖的原子结构可以用电子构型表示为 1s2 2s2 2p6。这种最外电子层为 8 电子的结构,通常是一种比较稳定的结构,称为稀有气体结构。
钠(Na)原子核外有 11 个电子,按照电子排布顺序,最后一个电子应填充到第三电子层上,它的电子构型为 1s22s2 2p6 3s1。为了避免电子结构式书写过繁,通常把内层电子已达到稀有气体结构的部分写成“原子实”,以稀有气体的元素符号外加方括号来表示,因此钠原子的电子构型也可以表示为[Ne]3s1。
钾(K)原子核外有 19 个电子,由于 3d 和 4s 轨道能级交错,第 19 个电子填入 4s 轨道而不填入 3d 轨道,其电子构型为 1s2 2s2 2p63s2 3p6 4s1 或[Ar]4s1。同理 20 号元素钙(Ca)的第 19,20 个电子也填入 4s 轨道,钙原子的电子构型为[Ar]4s2。
铬(Cr)原子核外有 24 个电子,最高能级组中有 6 个电子。铬的电子构型为[Ar]3d54s1,而不是[Ar]3d44s2。这是因为 3d5 的半充满结构是一种能量较低的稳定结构。
根据核外电子排布原则和光谱实验的结果,可确定原子的核外电子排布。附录 1 列出了各元素的原子核外的电子构型。
电子排布原理是概括了大量事实后提出的一般规律,因此绝大多数原子的核外电子的实际排布与这些原理给出的结果是一致的;然而有些副族元素,特别是第五、六、七周期的某些元素,实验测定结果并不能用电子排布原理完满地解释。因此,对于某一个具体元素的原子电子排布情况,要以光谱实验的结果为准,原理总是有其相对近似性的,科学的任务是承认矛盾, 发展原理,使它更加符合实际。
