分子间作用力和氢键
相邻原子间的强烈作用力称为化学键,分子与分子间则有比较弱的作用力,一般在 10kJ·mol-1 以下。共价键的键能是 102 数量级(见表 3-2), 而离子键晶格能则是 102~103 数量级(见表 3-1)。极性分子是一种偶极子, 具有正负两极。当它们靠近到一定距离时,就有同极相斥,异极相吸的静电引力,但这种引力比离子键的晶格能弱得多。极性分子与非极性分子之间作用力则是由极性分子偶极电场使邻近的非极性分子发生电子云变形(或电荷位移)而相互作用产生的,如 O2(或 N2)溶于水中,O2 和 H2O 分子间的作用力就是这种情况。非极性分子与非极性分子之间的作用力来自电子在不停运动瞬间总会偏于这一端或那一端而产生的瞬间静电引力。原子半径越大越容易产生瞬间静电引力。稀有气体是单原子分子,这是典型的非极性分子,它们的液化过程,就是靠这种瞬间静电引力。由氦(He)到氙(Xe)半径依次递增,瞬间的静电作用力也依次递增,沸点依次升高。
|
氦( He ) |
氖( Ne ) |
氩( Ar ) |
氪( Kr ) |
氙( Xe ) |
|
|---|---|---|---|---|---|
|
沸点/℃ |
- 269 |
- 246 |
- 186 |
- 153 |
- 107 |
|
沸点/K |
4 |
27 |
87 |
120 |
166 |
总之,分子间作用力是由分子之间很弱的静电引力所产生,物质的许 多物理化学性质如沸点、熔点、粘度、表面张力等都与此有关。
氢键是一种特殊的分子间作用力,其能量约在 10~30kJ·mol-1 间。F, O, N 电负性很强,与 H 形成的共价键显较强极性,共用电子对偏于 F 或 O 或 N 这边而使其为负极,H 则为正极。当另外一个电负性强的原子接近 H 时, 就会产生静电引力。**氢原子和电负性强的 X 原子形成共价键之后,又与另外一电负性强的 Y 原子产生较弱的静电引力,这种作用力叫氢键。**可以表示为:
X-H⋯Y
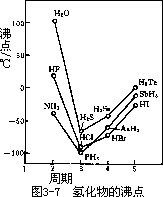
如第 VIA 族氧(O)、硫(S)、硒(Se)、碲(Te)的氢化物的沸点递变规律,由 H2Te,H2Se 到 H2S,随分子量的递减,半径递减;随分子间作用力的减小,沸点递减。但分子量最小的 H2O 的沸点却陡然升高,见图 3-7。这是因为氧的电负性很强,H2O 分子间形了 O-H⋯O 氢键,所以 H2O 分子间作用力大于同族其他氢化物。ⅦA 和 VA 族氢化物沸点的变化规律中,HF 和 NH3 也显得特殊,这也是因为形成了 F-H⋯F 和 N-H⋯N 氢键。H2O,HF,NH3 分子间的氢键,在固态、液态都存在,它们许多特性都可以用氢键概念加以解释。例如绝大多数物质的密度,总是固态大于液态的,但 H2O 在 0℃附近的密度却是液态大于固态的。这是因为固态 H2O(冰)分子间存在 O-H⋯O 氢键,使它具有空洞结构,此时冰的密度就小于水,所以冰可浮于水面。详见第 4 章。
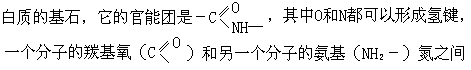 用上述这些简单的无机分子为例容易说明氢键的概念,但这个概念的重要性却体现在生命化学中。生物体内存在各式各样的氢键。氨基酸是组成蛋
用上述这些简单的无机分子为例容易说明氢键的概念,但这个概念的重要性却体现在生命化学中。生物体内存在各式各样的氢键。氨基酸是组成蛋
可形成 C=O⋯H-N 氢键。DNA 双螺旋结构中也有大量氢键相连而成稳定的复杂结构。在本书第 10 章还将提到这些问题。
