催化作用
催化作用是一个应用广泛的领域。催化剂能显著改变反应速率,但不影响反应的平衡位置。催化剂使反应物顺捷径变为生成物,但它本身的组成和数量都保持不变。凡能加快反应速率的催化剂称为正催化剂,而能减慢反应速率的则称为负催化剂,也叫抑制剂,如防止塑料、橡胶老化的添加剂就属这类物质。一般所说的催化剂是指加快反应速率的正催化剂。
当代石油化工的巨大成就与催化剂在工业上的广泛应用密切相关,催化剂的研制已是石油化工行业不可缺少的组成部分。石油炼制过程中的裂解、重整、加氢精制,塑料、橡胶、化纤工业中单体合成和聚合,无机化工原料合成氨、硝酸、硫酸的生产等等都是随工业催化剂的研制成功而迅速发展的。
从分子生物学的角度看,人体是一个极其复杂而有趣的催化体系。现在已知人体中有两千多种酶,每种酶能催化一种反应。要了解生命现象的奥秘, 必须了解酶的作用。再如汽车尾气的净化、酸雨的形成等与环境保护有关的问题也都涉及催化作用。催化理论至今还不成熟,这里只介绍两个公认的特点:一是催化剂降低了化学反应的活化能,二是催化剂有选择性。
什么是活化能呢?化学反应的实质是化学键的改组,断键时要吸收能量,成键时则释放能量,反应过程中能量变化如图 2-5 所示。反应物 A 与BC 发生反应的过程中,旧键将断未断,新键将
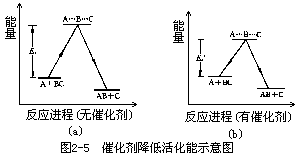
成未成的瞬间,体系处于过渡状态,叫活化态(A⋯B⋯C),活化态与起始态之间的能量差 Ea 叫活化能(图 2-5(a)),当有催化剂存在时所需活化能降为 Ea′(图 2-5(b))。也可以说:A 和 BC 起反应生成 AB+C 的过程,必须越过一个能垒,催化剂的作用在于降低了这个能垒,使反应物 A 和 BC 能顺捷径很快地转化为生成物 AB 和 C。例如乙醛(CH3CHO)分解为甲烷(CH4)和 CO 时,在 518℃,活化能 Ea=190kJ·mol-1,而用碘(I2)作催化剂,活化能 Ea′则降低为 136kJ·mol-1。
CH3CHO→CH4+CO Ea=190kJ·mol-1
CH3CHO I2→ CH4 + CO Ea ' = 136kJ • mol−1
又如蔗糖(C2H22O11)可水解为葡萄糖(C6H12O6)和果糖(C6H12O6)。葡萄糖和果糖的化学式相同,但结构式不同:
C12H22O11+H2O——→C6H12O6+C6H12O6
蔗糖 葡萄糖 果糖
这是人体内一个很重要的化学反应,在蔗糖酶的催化作用下,活化能 E’a 为 36kJ·mol-1,若在室温试管中,所需活化能要高得多,约 107kJ·mol-1, 即反应速率慢得多。催化剂降低了反应活化能,加快了反应速率,这已是
共识,但活化能是怎样降低的,还众说纷纭,没有统一的看法。
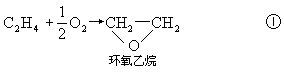 催化剂的另一特点是选择性。许多反应可以生成多种产物,催化剂可以使反应定向进行。例如乙烯和氧气可以发生下列
3 种反应:
催化剂的另一特点是选择性。许多反应可以生成多种产物,催化剂可以使反应定向进行。例如乙烯和氧气可以发生下列
3 种反应:
C2 H 4
- 1 O
2
2→CH3 CHO ②
乙醛
C2 H 4 + 3O 2 →2CO2 + 2H 2 O ③
我们需要利用反应①制造环氧乙烷,或用反应②制造乙醛,但不希望得到的是这两种产物的混合物;至于反应③,则希望尽量少发生,因为这个反应是把宝贵的乙烯完全烧成了无用的 CO2 和 H2O。现在已经研制成功用Ag/Al2O3 催化剂走向加速反应①制得环氧乙烷,用氯化铜-氯化钯(CuCl2
-PdCl2)的盐酸溶液定向加速反应②获得乙醛。这是 60 年代化学工业上的一项重大成就。又如钴-钼/三氧化二铝(Co-Mo/Al2O3)催化剂加氢脱硫效果好,而镍-钨/三氧化二铝(Ni-W/Al2O3)催化剂加氢脱氮效果好。催化剂为什么能有选择性,是催化研究的重要课题。
不论是石油化学工业,还是生物化学、环境化学、材料化学等领域都涉
及各种与催化作用有关的问题。催化研究既有其理论意义,又有明显的应用背景,受到科技界和工业界的普遍关注。
