经典的 Lewis 八隅体规则
上面一节已介绍 s2p6 八电子稳定状态及离子键的形成,但两个电负性相等或相近的原子结合形成分子时(如 H2,O2,N2,HCl 等),显然不可能以得、失电子的方式形成稳定的八电子结构。1916 年 Lewis 提出共用电子对形成八隅体的学说,例如 A 和 B 两个 Cl 原子形成 Cl2 时,各有一个电子,既属于 A 又属于 B,或者说 A 和 B 两个 Cl 原子共有这对电子,那末 A 和 B 原子都形成稳定的八电子结构。可以·代表 A 原子的外层电子,以×代表 B 原子的外层电子,也可以用短线代表共用电子对。以下列举若干常见的共价分子的Lewis 结构式。
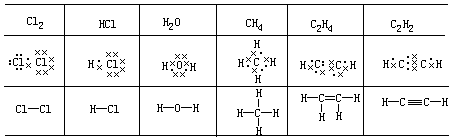
A 和 B 两个原子间,若共用 2 对电子,则形成双键;共用 3 对电子则形成三键。C2H4 分子内含有碳碳双键,C2H2 分子内含碳碳三键。Lewis 认为原子可以通过共用电子对形成八电子稳定结构,这种原子间的作用力称为 共价键。用这个概念可以阐明许多非金属原子间形成共价化合物的规律,至今仍为化学界采用。但他并未能阐明共价键的本质和特性,成键电子对的两个电子都带负电,同性相斥,它们是怎样结合的?也有不少共价分子的结构和性质不能用八隅规则说明。因此随后发展成价键理论。
