键的极性和分子的极性
在 H2(或 I2)分子中,两个成键的 H 原子(或 I 原子)对共用电子对的吸引能力是相等的,整个分子的正电荷中心和负电荷中心是重合的,这种分子为非极性分子,H-H(或 I-I)键为非极性共价键。但 HI 分子则是极性分子,H-I 键是极性共价键。因为 I 的电负性(2.5)大于 H(2.1),所以H-I 键的共用电子对偏向于 I 的一端。或者说 HI 分子中,I 端显负性,而 H 端为正性。凡**由电负性不同的两个原子形成的共价键为极性共价键,**它们 的共用电子对偏向电负性大的一方,使电负性大的原子带部分负电荷,电
6 + 6 −
负性小的原子带部分正电荷,可以分别用δ + 和δ -表示,如H — I 。两个成键原子的电负性差值(△χ)越大,键的极性就越大。当 0<△χ<1.7 时,为极性共价键;当△χ>1.7 时,电子对将完全偏于电负性大的原子一
边,这就和离子键一样了。例如 Cl 的电负性为 3.0,Na 为 0.9,Mg 为 1.2, Na 和 Cl,Mg 和 Cl 之间△χ值都大于 1.7,因而都形成离子键。由此可见离子键和共价键虽然是两种不同的化学键,但它们之间有联系,从离子键到共价键有递变关系。例如 BeCl2 中的 Be(χ=1.5)和 Cl 之间△χ为 1.5,Be 和 Cl 原子形成极性很强的共价键,BeCl2 在室温虽是固体,但熔点(405℃) 比离子化合物如 MgCl2(714℃),CaCl2(782℃)低得多,BeCl2 的性质可以说是介于离子化合物和共价化合物之间的过渡状态。
键的极性是一种“矢量”,不但有大小,还有方向,它的方向用从正极到负极的方向表示。分子的极性与键的极性有关,在双原子分子中,键有极性,分子就有极性,如 HI,HCl 等。但以极性键结合的多原子分子,是否有极性,还要看分子的空间构型,因为它决定键的方向。若分子结构的对称性使键的极性互相抵消,则分子没有极性。如 CO2 分中的 C=O 键是极性键,但由于 CO2 分子呈直线型对称结构,两个 C=O 键的极性大小相等,方向相反, 互相抵消,整个分子就成了没有极性的非极性分子:
← →
C = C = O
图 3-6 列举了 CH4,NH3 和 H2O 分子的构型和键角。如 CH4 分子中,C-H 虽是极性键,其中 C 用 4 个 sp3 杂化轨道,以正四面体方向与 H 成键,所以CH4 也是非极性分子。见图 3-6(a)。而 H2O 则不然,它是极性分子,因为O 原子用 2 个 sp3 杂化轨道分别和 2 个 H 原子形成σ键,另外两个 sp3 杂化轨道上各有一对未成键的电子,它们的互斥作用使 H2O 分子中两个 H-O 键间的夹角为 104.5°,使整个 H2O 分子呈 V 字型,O 为负端,H 为正端,见图 3-6
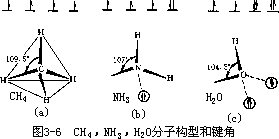 。NH3
分子的情况和 H2O 相似,N-H 键是极性键,键角为
107°,有一对未成键电子,因此 NH3 分子有极性。N 为负端,H
为正端,见图 3-6(b)。
。NH3
分子的情况和 H2O 相似,N-H 键是极性键,键角为
107°,有一对未成键电子,因此 NH3 分子有极性。N 为负端,H
为正端,见图 3-6(b)。
汽油的主要成分之一是辛烷(C8H18),它由于结构的对称而是非极性分子,乙醇(C2H5OH)分子一端是极性很小的烷基(C2H5-),另一端是极性较大的羟基(-OH),它是极性分子。汽油和水不相溶就是因为它们分子极性差别所致,而乙醇和水的互溶性正是因为它们有极性相似的-OH 基团。
价键理论、杂化轨道等共价键概念确实解释了许多化学现象而获得公认,但也还有不少现象无法解释,因此随后又有价层电子互斥理论、分子轨道理论、晶体场理论等多种学说的发展和应用,因涉及较深的数学和物理知识,本书不再介绍。总之,人类对事物内在本质的认识就是这样逐步深入的, 永无止境。
