配位键和配位化合物
AgCl 是一种难溶于水的白色沉淀,每 100g H 2O 中可以溶解 1.35×10-4g AgCl,因此常利用 Cl-与 Ag+生成 AgCl 沉淀反应去检出 Ag+或 Cl-。AgCl 既不溶于强酸,也不溶于强碱,却易溶于氨水,这是因为 Ag+和 NH3 可以形成可溶性的[Ag(NH3)2]+:
 AgCl+2NH3·H2O
[Ag(NH3)2]++Cl-+2H2O
AgCl+2NH3·H2O
[Ag(NH3)2]++Cl-+2H2O
[Ag(NH3)2]+叫银氨络离子或配离子,其中 Ag+和 NH3 用配位键相结合, 这类化合物叫配位化合物,简称配合物,也叫络合物。周期表里 d 区和 f 区金属元素都容易形成配合物,特别是金属和有机分子形成的配位化合物,普遍存在于各种体系中。生物化学、催化、分析化学等领域都在广泛研究各类配位化合物的合成、结构和性质。配位化合物有何特征?配位键与共价键有何异同?
配位化合物是一类比较复杂的分子间化合物,其中含有一个复杂离子, 它是一个稳定的结构单元,可以存在于晶体中,也可以存在于溶液中,可以是正离子,也可以是负离子。例如:



 CuSO4+4NH3
[Cu(NH3)4]SO4 [Cu(NH3)4]2++SO42- 3NaF+AlF3 Na3[AlF6]
3Na++[AlF6]3-
CuSO4+4NH3
[Cu(NH3)4]SO4 [Cu(NH3)4]2++SO42- 3NaF+AlF3 Na3[AlF6]
3Na++[AlF6]3-
在[Cu(NH3)4]2+中的 4 个 NH3 分子位于同一平面上,以正四边形的方位与 Cu2+结合,其中 Cu2+位于四边形的中心位置,叫中心体;NH3 分子位于四边形的顶角,叫配位体;有 4 个 NH3 与 Cu2+相配,因此 Cu2+的配位数为 4; 整个离子叫内界,用方括号括在一起;SO42-则为外界。
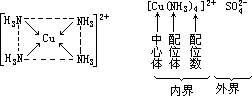
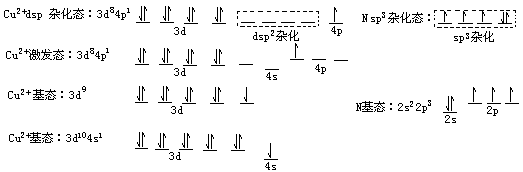
Cu2+和 NH3 之间的结合力与共价键略有不同,叫配位键,现以此为例说明配位键的本质。基态 Cu 的外层电子结构是 3d104s1,失电子成 Cu2+后为 3d9, 其中有 1 个 3d 电子被激发到 4p 轨道之后,能量相近的 1 个 3d,1 个 4s 和 2 个 4p 轨道杂化形成 4 个能量相等的 dsp2 杂化轨道,这是 4 个空轨道。
 NH3
分子中 N 原子的 4 个 sp3 杂化轨道上有 3 个未成对电子,可以和 3 个H 形成
N-H 键,此外还有一对未成键的孤对电子,它们恰好与 Cu2+的 dsp2
NH3
分子中 N 原子的 4 个 sp3 杂化轨道上有 3 个未成对电子,可以和 3 个H 形成
N-H 键,此外还有一对未成键的孤对电子,它们恰好与 Cu2+的 dsp2
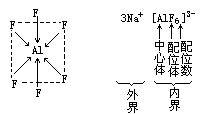
杂化空轨道相结合形成配位键。Cu 与 N 之间也共用了一对电子,但这对电子是由 N 提供的,而 Cu 则提供了空轨道,我们用 N→Cu 表示,箭头指向具有空轨道的原子,以便与共价键的短线区别。总之,一个原子有杂化空轨道,另一个原子有孤对电子,两者可结合,借这类结合形成的化学键称为配位键。[AlF6]3-中的情况也差不多。Al 是中心体,F-是配位体,配位数为 6,内
界带负电荷,配离子为负 3 价,外界是 3 个 Na+。[AlF6]3-为正八面体结构, Al 位于八面体中心,6 个 F-位于八面体的顶点,这 6 个 F→Al 配位键是等长的,其中 4 个 F-位于同一平面正四边形的顶角,另外 2 个分别位于四边形的上方与下方,这 6 个 F-形成的八面犹如一个网兜将 Al3+装在八面体的中心。这类化合物形象地也叫络合物,“络”字的含义就是指网络或网袋的意思。
d 区元素和 f 区元素有足够的 d 轨道和能量相近的 s 轨道、p 轨道进行杂化,提供若干空轨道;多种负离子或中性分子(可以是简单的无机分子,也可以是很复杂的的有机分子)中有未成键的孤对电子,这两类原子容易以配位键相结合形成配位化合物。这类化合物品种繁多,结构复杂,用途广泛, 是现代无机化学的重要研究领域。
