电子云的概念
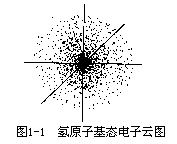
对宏观物体的运动,可以用经典力学来描述。例如火车在轨道上奔驰, 人造卫星按一定轨道围绕地球运行,都可以测定或根据一定的数据计算出它们在某一时刻所在的位置和速度,并能描绘出它们的运动轨迹。而在原子核外运动的电子则不同,它不遵循经典力学的规律,必须用 20 世纪初创立的量子力学理论来描述。现已经证明电子在核外空间所处的位置及其运动速度 不能同时准确地确定,也就是不能描绘出它的运动轨迹。在量子力学中采用统计的方法,即对一个电子多次的行为或许多电子的一次行为进行总的研究,可以统计出电子在核外空间某单位体积中出现机会的多少,这个机会在数学上称为概率密度。例如氢原子核外有一个电子,这个电子在核外好像是毫无规则地运动,一会儿在这里出现,一会儿在那里出现,但是对千百万个电子的运动状态统计而言,电子在核外空间的运动是有规律的,在一个球形区域里经常出现,如一团带负电荷的云雾,笼罩在原子核的周围,人们称之为电子云。这团“电子云雾”呈球形对称,如图 1-1 所示。电子云是电子在核外空间出现概率密度分布的一种形象描述。原子核位于中心,小黑点 的密疏表示核外电子概率密度的大小。
- 四个量子数
量子力学对核外电子运动状态的描述引出四个量子数,即电子的运动状态可以用四个量子数来规定。主量子数 n,角量子数 l,磁量子数 m 和自旋量子数 ms。其中 n,l 和 m 三个量子数确定电子在空间运动的轨道,称为原子轨道。当然电子运动并不是真有确定的轨道,量子力学理论认为电子在整个 原子空间都有可能出现,只是在各处出现的概率密度不同,因而运动状态也不同。电子不仅在核外空间不停地运动,而且还做自旋运动,自旋量子数 ms规定电子自旋运动状态。所以,电子的运动状态通常由 n,l,m 三个量子数决定轨道运动,由 ms 决定自旋运动。这四个量的具体含义和取值大致如下。主量子数 n 它规定了核外电子离核的远近和电子能量的高低。由近及
远,由低至高,n 可取正整数 1,2,3,4⋯n 值越大,表示电子离原子核越远,能量越高。反之,n 越小,则电子离核越近,能量越低。由于 n 只能取
正整数,所以电子的能量是分立的不连续的,或者说能量是量子化的。这也相当于把核外电子分为不同的电子层,凡 n 相同的电子属于同一层。习惯用K,L,M,N,O,P 来代表 n=1,2,3,4,5,6 的电子层。
角量子数 l 它描述的是电子在原子核外出现的概率密度随空间角度的变化,即决定原子轨道或电子云的形状。l 可取小于 n 的正整数,即 0,1,2,⋯, n-1,如 n=4,l 可以是 0,1,2,3,相应的符号是 s,p,d,f⋯例如 l=0, 就用 s 表示,l=1 用 p 表示等等。对含有多于 1 个电子的原子(或称多电子原子),当 n 相同时,l 越大,电子的能量越高。因此,常把 n 相同,l 不同的状态称为电子亚层,一个电子层可以分为几个亚层。如 n=2(L 层),有两个亚层,即 l=0 和 1,相应的原子轨道符号为 2s 和 2p;当 n=3(M 层)时, 有 l=0,1,2 三个亚层,可分别用 3s,3p 和 3d 表示。以此类推。
 磁量子数
m 它规定电子运动状态在空间伸展的取向。 m
的数值可取0,±1,±2,⋯,±l。对某个运动状态可有 2l+1 个伸展方向。s 轨道的
l=0, 所以只有一种取向,它是球对称的。p 轨道
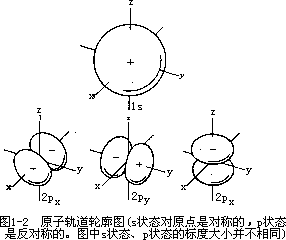
l=1,m=-1,0,+1,所以有三种取向,用 Px,Py 和 Pz 表示。图 1-2 为 s 和
p 原子轨道轮廓图。s 轨道在空间伸展取向呈球对称,而 px 轨道伸展取向垂直于
yZ 平面,py 取向垂直于 xz 平面,而 Pz 取向则垂直于 xy 平面。
磁量子数
m 它规定电子运动状态在空间伸展的取向。 m
的数值可取0,±1,±2,⋯,±l。对某个运动状态可有 2l+1 个伸展方向。s 轨道的
l=0, 所以只有一种取向,它是球对称的。p 轨道
l=1,m=-1,0,+1,所以有三种取向,用 Px,Py 和 Pz 表示。图 1-2 为 s 和
p 原子轨道轮廓图。s 轨道在空间伸展取向呈球对称,而 px 轨道伸展取向垂直于
yZ 平面,py 取向垂直于 xz 平面,而 Pz 取向则垂直于 xy 平面。
图 1-2 原子轨道轮廓图(s 状态对原点是对称的,p 状态是反对称的。图中 s 状态、p 状态的标度大小并不相同)
自旋量子数 ms 电子除绕原子核运动外,它本身还做自旋运动。电子
自旋运动有顺时针和逆时针两个方向,分别用m = + 1 和m = 1
s 2 s
- 2 表示,
也常用↑和↓符号表示自旋方向相反的电子。表 1-1 归纳了四个量子数的关系。
表 1 - 1 量子数和原子轨道
|
量子数 |
原子轨道 |
电子层可容纳电子总数 |
||||
|---|---|---|---|---|---|---|
|
n |
l | m |
ms |
名称 |
容纳电子数 |
|
|
1 ( K 层) |
0 |
0 |
± 1/2 |
ls |
2 |
2 × 12=2 |
|
2 ( L 层) |
0 |
0 |
± 1/2 |
2s |
2 |
2 × 22=8 |
|
1 |
+1 |
± 1/2 |
2p |
6 |
||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
3 ( M 层) |
0 |
0 |
± 1/2 |
3s |
2 |
2 × 32=18 |
|
1 |
+1 |
± 1/2 |
3p |
6 |
||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
2 |
+2 |
± 1/2 |
3d |
10 |
||
|
+1 |
± 1/2 |
|||||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
- 2 |
± 1/2 |
|||||
|
4 ( N 层) |
0 |
0 |
± 1/2 |
4s |
2 |
2 × 42=32 |
|
1 |
+1 |
± 1/2 |
4p |
6 |
||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
2 |
+2 |
± 1/2 |
4d |
10 |
||
|
+1 |
± 1/2 |
|||||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
- 2 |
± 1/2 |
|||||
|
3 |
+3 |
± 1/2 |
4f |
14 |
||
|
+2 |
± 1/2 |
|||||
|
+1 |
± 1/2 |
|||||
|
0 |
± 1/2 |
|||||
|
- 1 |
± 1/2 |
|||||
|
- 2 |
± 1/2 |
|||||
|
- 3 |
± 1/2 |
四个量子数的物理意义及数值之间的相互关系都是量子力学在处理波动方程时求解得到的,并有物理和化学的实验依据,本书不做阐述。这里仅把这些结论作为描述电子运动状态的符号使用。
