煤炭及其综合利用①
随着蒸汽机的发明和推广应用,煤逐渐成为能源的“主角”。最先大量用煤做能源的是英国。英伦三岛森林资源有限而又是产业革命的发源地,对煤炭有着迫切的需要。世界各地虽然都有煤炭资源,但分布并不均匀,绝大部分都埋藏在北纬 30°以上地区。预测储量前苏联最多,美国次之,我国为第三,三者之和占全球煤资源的 90%。煤炭作为化石燃料是非再生能源,按现在的开采速度估计,煤只能用几百年。煤炭可以直接燃烧,但这样只利用了煤炭应有价值的一半,对环境污染也比较严重。所以如何合理利用煤炭资源是很重要的问题,要了解煤炭的综合利用,有必要先了解煤炭的形成及其组成。
煤是由远古时代的植物经过复杂的生物化学、物理化学和地球化学作用转变而成的固体可燃物。人们在煤层及其附近发现大量保存完好的古代植物化石;在煤层中可以发现炭化了的树干;在煤层顶部岩石中可以发现植物根、茎、叶的遗迹;把煤磨成薄片,置于显微镜下可以看到植物细胞的残留痕迹。这些现象都说明成煤的原始物质是植物。
这些古代植物是怎样变成煤的呢?按生物演化过程,地球的历史可以分为古生代、中生代和新生代三大时期。气候温湿植物茂盛始于古生代中期, 距今已有 3 亿年之久。植物从生长到死亡,其残骸堆积埋藏、演变成煤的过程当然是非常复杂的。经地质学家、煤田学家、化学家们的共同努力,现代的成煤理论认为煤化过程是:植物→泥炭(腐蚀泥)→褐煤→烟煤→无烟煤, 这个过程称煤化作用。
植物生长茂盛并能大量繁殖的地方一般是沼泽、湖泊、浅海地区,气候湿润。枯死的植物残骸不断堆积,在细菌作用下腐败分解,表面部分能充分接触空气,完全分解为 CO2 和 H2O。但埋藏在下层的则在缺氧甚至无氧的条件下腐败,慢慢地形成黑色的腐殖质。随植物残骸的继续堆积和深埋,这些腐殖质就在无氧条件下脱水,以及在分解产物间的互相作用下生成了腐殖酸, 并变成棕褐色的凝胶状物质,称为泥煤(或泥炭),其中腐殖酸的含量可达55%~60%。随着地壳的下沉,粘土砂石堆积在泥煤之上形成一块顶板,在地热和顶板压力条件下,这些泥煤继续发生失水,并有硬结、紧缩等现象。这个过程很漫长,并使泥煤中的腐殖酸减少,氢和氧含量也减少,而碳含量增加,这就形成了褐煤。当它继续沉降到较深的地方时,煤层所受压力可以达 105~106kPa,地热温度可达 200℃左右,此时褐煤的腐殖酸含量、氢和氧的含量继续减少,碳含量不断增加,逐渐形成了烟煤,然后变成无烟煤。所以烟煤和无烟煤是老年煤,形成的时间最长,含碳量高,发热量高;而褐煤和泥煤则比较年轻,含碳量较低,发热量也较低。它们的含碳量范围大致如下:
|
无烟煤 |
烟煤 |
褐煤 |
泥煤 |
|
|---|---|---|---|---|
|
含碳量/% |
85 ~ 95 |
70 ~ 85 |
50 ~ 70 |
约 50 |
此外,它们的挥发物、水分、灰分和发热量也有差别。由于发生变化的环境不同,煤的组成差别可以很大,在煤炭工业界有多种详细的分类和牌号。
① 陈文敏,张自劭主编.煤化学基础.北京:煤炭工业出版社,
总之,煤是古代植物遗骸埋藏在地下,经过漫长的时间,处于空气不足的条件下逐渐形成的。“漫长”是万万年或千万年,这样漫长,无法在短期内重演,所以把煤看作不可再生能源。“空气不足”意味着植物中所含的碳和氢没有完全氧化(尤其是碳),这就是煤所含的潜在能量。植物生长借叶绿素吸收太阳能发生光合作用:
mCO
- nH O 叶绿素→ C (H O) + O
2 2 吸收太阳能 m 2 n 2
植物吸收太阳能,储存太阳能。腐殖过程和煤化过程,实际都是氧化过程,即上述反应的逆过程,并逐步释放能量。在缺氧的条件下,水分可以逸出,但碳就不能全部变成 CO2,而以碳原子相结合的形式固定下来。从煤的形成推本溯源,其能量乃是来自太阳能。
煤的化学组成虽然各有差别,目前公认的平均组成是:
|
元素 |
C | H | O | N | S |
|---|---|---|---|---|---|
|
含量/% |
85.0 |
5.0 |
7.6 |
0.7 |
1.7 |
 将其折算成原子比,可用
C135H96O9NS
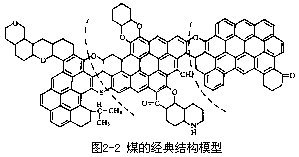
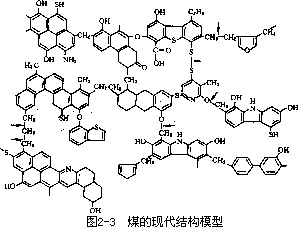
代表,此外也还有微量的其他非金属和金属元素。至于煤的化学结构,科学家们用多种化学的或物理的方法综合论证,至今已有几十种模型。60
年代以前的经典模型如图 2-2 所示。现代公认的模型如图 2-3 所示。
将其折算成原子比,可用
C135H96O9NS
代表,此外也还有微量的其他非金属和金属元素。至于煤的化学结构,科学家们用多种化学的或物理的方法综合论证,至今已有几十种模型。60
年代以前的经典模型如图 2-2 所示。现代公认的模型如图 2-3 所示。
由上图可见,煤炭中含有大量的环状芳烃,缩合交联在一起,并且夹着含 S 和含 N 的杂环,通过各种桥键相连。所以煤可以成为环芳烃的重要来源。同时在煤燃烧过程中有 S 或 N 的氧化物产生,污染空气。
煤在我国能源消费结构中位居榜首(约占 70%),煤的年消费量在 10
亿吨以上,其中 30%用于发电和炼焦,50%用于各种工业锅炉、窑炉, 20
%用于人民生活。就是说煤的大部分是直接燃烧掉的,其中 C,H,S 及 N 分别变成 CO2,H2O,SO2 及 NOx。这样热效率的利用并不高,如煤球热效率只有20%~30%;蜂窝煤高一点,可达 50%,而碎煤则不到 20%。至于工业锅炉用煤的热效率不仅与炉型结构有关,而且与煤的质量、形状、颗粒大小都有关系。煤开采后应该就地进行筛分、破碎,洗选除去一些无用的杂质。随着
机械化采煤的发展,煤粉的比例提高,所以还应将煤粉在加压加温条件下成型(球、棒、砖等),然后供应用户,以减少运输量,提高热效率。直接烧煤对环境污染相当严重,二氧化硫(SO2),氮的氧化物(NOx)等是造成酸雨的罪魁,大量 CO2 的产生是全球气温变暖的祸首。此外还有煤灰和煤渣等固体垃圾的处理与利用问题等。为了解决这些问题,合理利用和综合利用煤资源的办法不断出现和不断推广,其中最令人关心的一是如何使煤转化为清洁的能源,二是如何提取分离煤中所含宝贵的化工原料。现在已有实用价值的办法是煤的气化、煤的焦化和煤的液化。
煤的气化 是让煤在氧气不足的情况下进行部分氧化,使煤中的有机物转化为可燃气体,以气体燃料的方式经管道输送到车间、实验室、厨房等, 也可以作为原料气体送进反应塔。煤的气化过程涉及 10 个基本化学反应:
化学反应 △ H/kj · mol-1 特征
① C+O2=CO2 - 406 完全燃烧,放热
1
②C + 2 O2 = CO
- 123 不完全燃烧,放热
③ C+CO2=2CO +160 还原反应,吸热
④ C+H2O=CO+H2 +118 水煤气的生成
⑤ C+2H2O=CO2+2H2 +76 生成水煤气时的副反应
⑥ CO+H2O=CO2+H2 - 3 水煤气的变换,制 H2
⑦ C+2H2=CH2 - 75 甲烷的生成
⑧ CO+3H2=CH4+H2O - 250 甲烷的生成
⑨ 2CO+2H2=CH4+CO - 247 甲烷的生成
⑩ CO2+4H2=CH4+2H2O - 253 甲烷的生成
其中 H2,CO,CH4 都是可燃气体,也是重要的化工原料。例如化肥厂在合成氨时,需要原料 H2,可利用反应④和⑥;供居民用燃料时最好的是 CH4, 以反应⑦最理想,反应④生成的水煤气(CO+H2),虽然热值也很高,但 CO 毒性大,H2 又易爆,所以不如 CH4 气安全。根据煤气的不同用途,工程师们调节煤和空气、水和空气的比例,改进汽化炉的结构,控制反应温度和压力等条件以达到强化需要的反应,抑制不需要的反应的目的,作为燃料用的煤气实际是 H2,CO,CO2,CH4,N2(由空气带入)的混合气体,它若作为化工原料对气体纯度有一定的要求,则对条件的控制要求更高,并还要适当地分
离提纯。
煤的焦化 也叫煤的干馏。这是把煤置于隔绝空气的密闭炼焦炉内加热,煤分解生成固态的焦炭、液态的煤焦油和气态的焦炉气。随加热温度不同,产品的数量和质量都不同,有低温(500~600℃)、中温(750~800℃) 和 高 温 ( 1000 ~ 1100 ℃ ) 干 馏 之 分 。
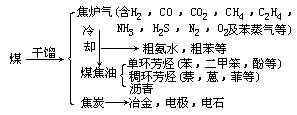
低温干馏所得焦炭的数量和质量都较差,但焦油产率较高,其中所含轻油部分,经过加氢可以制成汽油,所以在汽油不足的地方,可采用低温干馏。中温法的主要产品是城市煤气,而高温法的主要产品则是焦炭。
焦炭的主要用途是炼铁,少量用作化工原料制造电石、电极等。煤焦油是黑色粘稠性的油状液体,其中含有苯、酚、萘、蒽、菲等重要化工原料, 它们是医药、农药、炸药、染料等行业的原料,经适当处理可以一一加以分离。对照图 2-2 和 2-3(煤的结构模型),煤焦油中所含环状有机物可以说是煤的“碎片”。此外还可以从煤焦油中分离出吡啶和喹啉,以及马达油和建筑和铺路用的沥青等。从煤焦油里分离鉴定的化合物已有 400 余种。从炼焦炉出来的气体,温度至少在 700℃以上,其中除了含有可燃气体 CO,H2, CH4 之外,还有乙烯(C2H4),苯(C6H6),氨(NH3)等。在上述气体冷却的过程中氨气溶于水而成氨水,进而可加工成化肥;苯等芳烃化合物不溶于水而冷凝为煤焦油;乙烯等沸点高的气体,根据煤气的不同用途酌情处理。总之,煤经过焦化加工,使其中各成分都能得到有效利用,而且用煤气作燃料要比直接烧煤干净得多。
煤的液化 煤炭液化油也叫人造石油。煤和石油都是由 C,H,O 等元素组成的有机物,但煤的平均表现分子量大约是石油的 10 倍,煤的含氢量比石油低得多。所以煤加热裂解,使大分子变小,然后在催化剂的作用下加氢
(450~480℃,12~30MPa)可以得到多种燃料油。原理似乎简单,实际工艺还是相当复杂的,涉及裂解、缩合、加氢、脱氧、脱氮、脱硫、异构化等多种化学反应。不同的煤又有不同的要求。最近 20 年来美国、日本、德国等科学家都致力于这方面的研究,已有多种较好的设计方案。
上述这种先裂解再氢化的方法称直接液化法。另外还有一类方法称间接液化法,它是先使煤气化得到 CO 和 H2 等气体小分子,然后在一定的温度、压力和催化剂的作用下合成各种烷烃( CnH2n+2 )、烯烃(CnH2n )和乙醇
(C2H5OH)、乙醛(CH3CHO)等。第一个采用间接液化法的工厂建成于 1935
年,至今已有 60 年历史。目前还有少数缺油富煤的国家采用这种方法。
综上所述,煤既是能源,也是重要的化工原料。我国是世界上最大的耗煤国家,但 70%的煤都是直接烧掉,既浪费资源,也污染环境。积极开展煤的综合利用是十分重要的方针。
