伴随酰胺水解中的羰基氧交换
一级酰胺碱性水解过程中的羰基氧交换已被观察到.通过使用 18O 标记
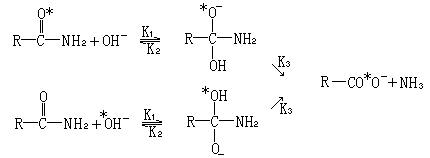 (O*=18O)观察到的这一交换,是经过一个四面体的半原酰胺中间体而发生的.所观察到的广泛的羰基氧交换可通过这样的事实来解释,即
K2 大于 K3, 因为羟基是比胺基好得多的离去基团.
(O*=18O)观察到的这一交换,是经过一个四面体的半原酰胺中间体而发生的.所观察到的广泛的羰基氧交换可通过这样的事实来解释,即
K2 大于 K3, 因为羟基是比胺基好得多的离去基团.
我们将看到,这一技术可用来证明立体电子控制原理在从酰胺衍生出的四面体中间体中的重要性,并对一级、二级和三级酰胺以及 N-氢和 N-烷基内酰胺进行考察.
立体电子控制的氢氧负离子和 18O 标记的一级酰胺 15*(R′=H)(图 2) 的反应,应该专一地形成四面体构象体 16(R′=H).
通常认为,在两个氧上的质子转移可以在中间体 16(R′=H)断裂之前发生.对于氮上的质子转移也作同样的设想.因此,16(R′=H)→17(R′=H) 的转化是可行的.氮原子和溶剂之间的质子转移可通过下列过程发生.中间体16(R′=H)具有合适的电子对取向(初级电子效应),而且能够给出起始酰胺 15*(R′=H)和其水解产物,或者通过 17(R′=H)给出未标记酰胺 15(R
′=H).因为 K2 大于 K3(羟基是比胺基好的离去基团),所以一级酰胺的主要表现应该是交换,这一预测得到了实验的支持.
使用二级酰胺可以得出类似的结论.在二级酰胺的最稳定构象中,像在
15*中那样,氮原子上的烷基与羰基氧原子处于顺式.与氢氧负离子的反应应该生成 16,16 也可以转化成 17.这样,二级酰胺在碱性水解过程中,应该与溶剂进行羰基氧交换,这也与实验结果相符.
在一级和二级酰胺中存在着羰基氧交换这一事实,是与立体电子控制原理相符合的.但是,这一事实不能构成这一原理的证据,因为不用这一原理也能够解释这些实验结果.
立体电子控制的氢氧负离子与 18O 标记的三级酰胺(18*)(图 3)的反应,应该给出中间体 19,它只能通过两种途径碎裂,或者生成起始标记的酰胺 18*,或者生成水解产物;在初级电子效应帮助下,19 的直接断裂不能给出未标记的酰胺 18.在立体电子控制下,为了形成未标记的酰胺 18,中间体19 必须首先转化成另一种构象体如 20.因而,三级酰胺中的氧交换取决于,
中间体 19 给出中间体 20 或通过直接碎裂给出水解产物这两个方向的相对难易程度.这样,一级、二级和三级酰胺之间的主要区别在于:前两者在其相应的四面体中间体中,无需求助于氮原子上的构象变化,就能进行 18O 交换; 而在三级酰胺的情形中,18O 交换只有当氮原子上的构象可以变化时才能发生.
通过围绕 C-N 键旋转 120°,或者通过 N 原子反转后再旋转 60°,均可实现 19 到 20 的转化.同时,两个氧原子上相应的质子转移也必须发生.因为只有在速率上能够与碎裂过程竞争,构象变化才能发生,所以构象变化的能垒必须低于或者与碎裂过程的能垒相差不多.于是三级酰胺的碱性水解可以存在也可以不存在氧交换,这取决于构象变化和碎裂过程的相对能垒.
Bunton、Nayak 和 O′connor 已经对一级、二级和三级酰胺水解过程中的羰基氧交换进行了研究.他们观察到,除 N,N-二甲基苯甲酰胺外,苯甲酰胺和 N-甲基苯甲酰胺的碱性水解都伴随有水和酰胺之间的广泛氧交换.这样,由 N,N-二甲基苯甲酰胺衍生出的四面体中间体(19,R′=CH3、R=6H5) 进行碎裂比它们进行构象变化来得容易,在 N,N-二甲基苯甲酰胺中不存在羰基氧交换,这一事实为立体电子控制原理提供了有力的支持,因为只有考虑了这个原理,才能解释这一结果.
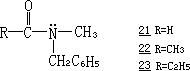 甲酰胺(21)、乙酰胺(22)和丙酰胺(23)标记的
N-甲基-N-苄基衍生物,在氢氧化钾(1.5mol/L)水溶液中,于
27℃进行的羰基氧交换和水解的速率已有过报道.
甲酰胺(21)、乙酰胺(22)和丙酰胺(23)标记的
N-甲基-N-苄基衍生物,在氢氧化钾(1.5mol/L)水溶液中,于
27℃进行的羰基氧交换和水解的速率已有过报道.
已经发现,甲酰胺中存在着显著的羰基氧交换,乙酰胺中很少,而丙酰胺中显然没有.因此随着 R 基团体积的增大(R=H、CH3、C2H5),对羰基氧交换越是不利.这一观察结果容易得到解释.在中间体 19 中,内旋转和氨基反转的能垒,当 R 小时应该较低,而 R 大时则较高.同时 19 的分解能垒,当 R 小时应该较高,而 R 大时则较低.当 R 为一大基团时,由于可以降低空间的压力而有利于中间体的分解.与这种降低空间压力的效应相反,是由酯(R-COOR
′)和酰胺(R-CONR′2)中 R 的大小所引起的经典的空间阻碍,这一阻碍影
响水解的速率.例如,甲酰胺的水解较乙酰胺快.这样,随着中间体 19 中 R 基团的增大,构象的变化应该减少,同时也应该导致羰基氧交换的减少,这一结论与实验相符合.
在较高温度(45、65、90℃)下,这三种三级酰胺的羰基氧交换和水解的速率也已测得,并观察到:随着温度的升高,氧交换速率的增加大于水解速率的增加.例如,在 27℃,N-甲基-N-苄基甲酰胺的水解比其进行羰基氧交换的速度快;但在 90℃,正好相反,氧交换比水解的速度快.原则上,温度的升高应该提高中间体的分解速率以及构象变化速度.一个过程的速率比另一过程的速率增长得快,似乎是出人意料的.因为两者在本质上具有相同的性质,都涉及分子的内部运动.因而,必定存在着一个熵因素,即随着温度的升高,它不利于四面体中间体的断裂,却有利于构象变化.
当一个半原酰胺四面体中间体以 T-离子形式存在时,该酰胺负离子在被溶剂质子化之前,不能断裂给出二级胺.酰胺负离子的形成 24→25 是一个能量如此之高的过程,以致于质子化和断裂两个过程必须同时发生24→26→27. 这意味着,在水溶液中,氮的电子对必须首先与溶剂形成氢键,以便这个基团可以作为二级胺离去.
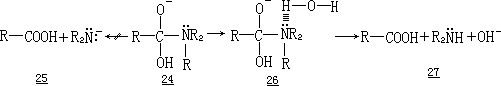
这样,四面体中间体在断裂能够发生之前,必须首先与溶剂形成氢键. 在低温下,与氮的氢键显然是有利的,在较高的温度下则不利.在此基础上, 中间体的分解在低温下有利,而在较高的温度下则不利.同时,高温下的构象变化(较少的氢键)应该比低温下的来得容易.这样,把四面体中间体中与氮形成的氢键的重要性考虑进去,很容易解释随着温度的升高、氧交换速率的增加大于水解速率的增加这一事实.
通过研究 N-2,6-二甲苯基-N-甲基甲酰胺(28)和 N-甲基-N-苯基甲酰胺(29),得到了N 上氢键重要性的明确证据.这两种甲酰胺之间的根本区别在于:与 29 相反,在 28 中的苯环与酰胺基团不共轭.在 28 中的苯环垂直于酰胺基团的平面,由 28 衍生出的亚胺盐的 X 射线分析支持这一点.有趣的是, 甲酰胺 28 不水解(0.15mol/L,KOH,90℃,70 小时),但进行了可观的羰基氧交换(>90%).这与 N-甲基-N-苯基甲酰胺(29)形成对照,后者的水解和羰基氧交换都容易进行.当甲酰胺 28 进行羰基氧交换时,一定形成四面体中间体 30,但由于在 30 中,N 上的氢键受到苯环(苯环与 N 的电子对平行) 上两个甲基的阻碍,所以 C-N 键的断裂不能发生.
乙酰胺(31)和丙酰胺(32)的 N-甲基-N-苯基标记衍生物的水解也已进行过研究.发现在 27℃, N-甲基-N-苯基酰胺 31 和 32 中存在着显著的氧交换,而 N-甲基-N-苄基酰胺 22 和 23 的情况却不是这样.这两种类型酰胺之
间的行为上的差别,可以通过 31 和 32 中的苯环来解释,这个苯环在四面体中间体中能够和氨基共轭.这种共轭效应必定降低了氮反转的能垒.结果 N 原子上两种可能的构象变化方式之一,即氮原子反转加上一个 60°的旋转,将是一个能量较低的过程.同时,胺基具有较弱的碱性,因而它应该与溶剂形成较弱的氢键,所以反转-旋转过程又将是有利的.
O
 R
C
R
C
O
H C
.
CH3
N
CH3
31 R =CH3
32 R= C2H5
CH3
N
CH3
33
CH3
发现 N,N-二异丙基甲酰胺 33 可缓慢水解,但发生广泛的氧交换.在 33 中,由两个异丙基的存在引起的阻碍,必定降低了形成四面体中间体的速度. 在四面体中间体中,异丙基对氢键也一定造成立体阻碍.四面体中间体的断裂变得异常困难,于是在这种情况下,构象变化比水解有利.
O*
R C
N CH3
CH2
在几个温度下,18O 标记的 N-苄基-N-甲基酰胺 34(R=H、CD3、CD2CH3) 在 D216O 中的水解和羰基氧交换的速率,已被仔细地测定过.通过做 ln(K/T) 对 1/T 的曲线发现的活化参数总结在表 2 中,其中 K 是水解( Kh )
或交换(Kex)的二级速率常数.水解的活化参数(△H ≠、△S≠、△G ≠)与以
前在类似酰胺中得到的数值一致.大的负活化■表明,为了使水解反应发生, 四面体中间体的氮一定与溶剂形成氢键.正如所料,甲酰胺对水解反应
