表 1 图 2 中四面体中间体 25 的九种构象体的断裂预测
表 1 图 2 中四面体中间体 25 的九种构象体的断裂预测
|
酯 26 |
构象体 |
酯 27 |
|---|---|---|
| Z |
A |
|
| Z | B |
E |
| Z | C |
Z |
|
|
D |
|
|
|
E |
E |
|
|
F |
Z |
| E |
G |
|
|
E
E |
H
I |
E Z |



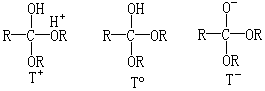
 半原酸酯中间体有一个弱酸性的氢(来自于
O—H
基团),并且在氧原子上,它们还有电子对可以在酸性介质中质子化.根据介质的酸度或碱度,它可以三种不同的离子形式
T+、TO 和 T-存在.因为半原酸酯的 pKa 大约为 10,所以,在酸性介质中,它以
T+和 TO 的形式存在;在中性介质中,基本上以 TO
的形式存在;在弱碱性介质中(pH≈8—10),以 TO 和
T-的形式存在;而在较强的碱性介质中(pH>11),应该只有 T-一种形式.
半原酸酯中间体有一个弱酸性的氢(来自于
O—H
基团),并且在氧原子上,它们还有电子对可以在酸性介质中质子化.根据介质的酸度或碱度,它可以三种不同的离子形式
T+、TO 和 T-存在.因为半原酸酯的 pKa 大约为 10,所以,在酸性介质中,它以
T+和 TO 的形式存在;在中性介质中,基本上以 TO
的形式存在;在弱碱性介质中(pH≈8—10),以 TO 和
T-的形式存在;而在较强的碱性介质中(pH>11),应该只有 T-一种形式.
某一给定中间体构象变化的能垒应该不太受离子状态的影响,但其断裂的能垒应该受到较大的影响;T+和 T-两种形式的断裂能垒应该较低,而中性形式 To 的较高.这与 Guthrie 的自由能数值符合,Guthrie 计算了在甲酸甲酯和乙酸甲酯的酸催化的、无催化的和碱催化的水解过程中,半原酸酯形成和断裂的自由能.
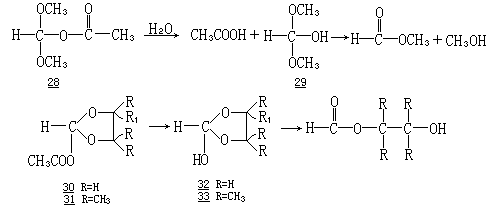
最近,Capon 和他的合作者们已经证实,中性四面体中间体可以在溶液中存在.因而 To 形式断裂的能垒较分子转动的能垒高得多.他们已经观察到,在—30℃丙酮和水的混合物中,二甲氧基丙酰氧基甲烷(28)生成了乙
酸和中间体 29,后者很容易通过 NMR 谱检测到.然后观察到中间体 29 的消失,生成了反应产物.用乙酰氧基-1,3 二氧杂戊烷(30)和它的四甲基衍生物 31 做了类似的实验.使用化合物 31,有可能得到一个溶液,其中多于 90
%的起始物转变为中间体 33.半原酸酯 33 的检测比 32 容易得多,因为 33 的
分解速度比 32 慢,而且 31 的水解速度比 30 快.McClelland、Kresge 和他们的同事们已经为环状原酸酯在水解反应中所生成的一些相应的环状半原酸酯的检测提供了很
好的证据.
在酸性介质中,半原酸酯是弱碱,To 形式就应该与 T+形式处于平衡状态存在,因而,在这种介质中,在半原酸酯分解之前,一定能够经历分子的转动.同时,到目前为止,还没有能说明分子转动可以与 T+离子形式的中间体断裂竞争的证据.T+形式的中间体断裂的能垒肯定比 To 形式的低,这是我们所知道的.在 pH 值高于 11 时,半原酸酯只以 T-离子形式存在;在某些情况下可以看到,T-断裂的能垒较分子转动的能垒低.
既然已经说明了初级和次级电子效应,还考察了四面体中间体的离子状态和其分解能垒的关系,以及分子转动可以与断裂竞争的可能性,因而希望能给出一些实验事实,表明在水解反应中存在着立体电子控制.应该指出的是,由于四面体中间体的寿命非常短,而且它们的立体化学知识不能直接得到,所以要找到证明这一理论的实验是不容易的.立体电子理论的巨大优越性在于它强调四面体中间体的立体化学的重要性,同时它还表明杂原子上的非键电子对在空间上的取向,对于理解这些物质的化学反应性是至关重要的. 很清楚,证明这一理论的严格的实验证据不能通过单一的一个实验获得.