环状原酸酯的水解
在温和的酸性条件下,由原酸酯水解生成酯,是通过形成四面体中间体半原酸酯进行的,如下面的方程式所示.
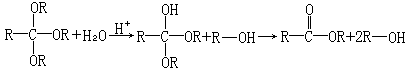
在环状原酸酯如 55 中(图 5),当两个烷氧基不同时,就有可能形成三种不同的半原酸酯(56、57 和 58),它们又可生成三种不同的酯:两个羟基酯 59 和 60 及一个内酯 61.这样,就有可能产生某种特定的半原酸酯,后者能导致这三种酯产物之一的优先形成.因而,原酸酯温和的酸水解是检验半原酸酯四面体中间体的形成和断裂过程中的立体电子控制原理的一个有力的方法.
首先考察两个烷氧基相同的环状原酸酯 55.这种原酸酯在理论上,有九种可能的邻位交叉构象体,如图 6 所示.然后要根据立体电子控制原理分析一下每一个构象体.
水解反应应该通过能量上最有利的构象体进行,这些构象体在适当的质子化之后,在初级和次级电子效应的帮助下,能够使一个烷氧基离去.在构象体 B 和 D 中,两个 R 基团之间有较强的立体相互作用;它们在平衡体系中的数量很小,按照类似的理由,也可以把构象体 G、H 和 I 排除掉;因为直键烷氧基的 R 基团与环的两个亚甲基(C3 和 C5)有较强的立体相互作用.剩下的四个构象体 A、C、E 和 F 没有强的立体相互作用,它们的断裂可以首先通过考虑初级立体电子效应(即每个氧上都有一电子对与离去基团处于反式共平面)来分析.
根据初级立体电子效应,构象体 A 和 E 可以通过直键烷氧基的离去而分解.构象体 F 可以通过环的 C-O 键断裂而分解,但构象体 C 不能发生分解(无初级电子效应).因而构象体 C-定是不活泼的,通过对三环原酸酯 62 反应性的研究,在实验上证实了这一预测,X 射线分析表明,62 是构象体 C 的一种完美的刚性模型.事实上,在通常用来水解其它环状原酸酯的弱酸性条件下, 化合物 62 是十分稳定的.这样,构象体 C 是一个很不活泼的构象体,它必须被排除掉.
现在,我们再通过考虑次级电子效应,来分析剩下的三个构象体 A、E 和 F 的反应性.在构象体 A 的直键 OR 基团的断裂过程中,环氧和平键氧都有一电子对与离去基团处于反式共平面(给出一个初级电子效应:n-σ*→n- π*).平键氧还有一电子对与环上的 C—O 键处于反式共平面,因而,有一个次级电子效应(n-σ*)来帮助这一断裂,生成 EZ 式的内酯盐离子 63.与此相比较,构象体 E 只在初级立体电子效应(n-σ*→n-π*)的帮助下,使直键烷氧基离去,给出 EE 式的内酯盐离子 64.构象体 F 可以在初级立体电子效应和一个次级电子效应的帮助下,经历环上 C—O 键的断裂,产生 EZ 式二烷氧基碳正离子 65.这样,根据次级电子效应,A 和 F 的断裂比构象体 E 的断裂有利.最后,构象体 F 的断裂和构象体 A 的断裂相比,前者一定是一个能量较高的过程,因为在反应 A→63 中,有两个分子(63 和醇)形成,环也没有打
开,而在反应 F→65 中,环发生断裂,只生成了一个分子.这样,在后一个过程中,其内逆转(65→F)可能是重要的.根据以上的分析预测,一个环状原酸酯只应该通过构象体 A 发生水解.
下一步的任务是对内酯鎓离子 63 的水合及所产生的半原酸酯的断裂进行分析.水对内酯鎓离子的进攻由于受立体电子控制,一定发生在β面上,产生四面体构象体 66(图 7).正像前面对内酯所进行的讨论,水对 63 的α面进攻将产生具有船式构象的中间体,因而不用考虑这一过程.
在温和的酸性条件下,四面体中间体以 To 和 T+形式存在,在其分解之前可以发生构象变化.这样在四氢吡喃环不易发生椅式转换的体系中,63 首先水合生成 66;然后 66 产生一个混合物,其中旋转异构体 66、67 和 68 处于平衡.在四氢吡喃环容易发生椅式转换的情况下,应该存在一个含有六种可能构象体 66—71 的平衡混合物.71 的相对数量可以忽略,因为这个构象体的 R 基团与环之间存在着强的立体相互作用.还应该指出,由于质子交换是一个快速过程,在这六种构象体中,OH 上氢的准确取向可不予以考虑.
通过考虑初级和次级电子效应,对这六种构象体断裂的预测结果如下. 构象体 67 不能发生分解(没有初级立体电子效应);因而它的反应性不活泼, 必须把它排除掉.构象体 66 可以产生一个具有 Z 式构象的羟基酯,而构象体68 应该可以产生一个具有 E 式构象的羟基酯.有趣的是,66—68 在初级立体电子控制下不能形成内酯.这样在四氢吡喃环具有刚性构象的情况下,水解反应一定优先通过构象体 66 发生,只产生具有 Z 式构象的羟基酯产物.
中间体 69 可以产生一个 Z 酯(羟基酯),或者产生一个 E 酯(内酯). 中间体 70 只能产生一个 E 酯(内酯),而中间体 71 可以产生两个 E 酯,即具有 E 构象的羟基酯和内酯.这样,初级立体电子效应允许中间体 69—71 的断裂,或者产生羟基酯,或者产生内酯.然而,69 断裂生成 Z 式羟基酯是有利的,它多出一个次级电子效应.在此基础上可以预测,使用构象易变的环状原酸酯,应该只观察到羟基酯这种水解产物.但另一方面,也应该指出,由于开环的可逆性,羟基酯的形成与内酯和醇的形成相比并不有利.如果这个因素和一个次级电子效应具有同样的重要性,内酯的形成就可以与羟基酯的形成相竞争.根据上面的分析,使用构象易变的环状原酸酯,应该得到羟基酯和内酯的混合物.
已报道的第一个结果表明,五个环状原酸酯 72—76(R=C2H5)在温和的酸性条件下进行水解,给出相应的羟基酯是反应的唯一产物.后来,Capon 和Grieve 发现,原酸酯 73(R=CH3 或 C2H5)水解生成羟基酯(70%)和内酯(30
%)的混合物.接着又重复了原酸酯 72—76 的水解实验.证实原酸酯 73 确实生成了羟基酯和内酯的混合物,比例大约为 7∶3.使用原酸酯 72 得到了类似的结果,但其它三个原酸酯 74—76 仅给出羟基酯,这也证实了以前所报道的.
化合物 74 和 75 不易发生椅式的转换,因为 74 和 75 的甲基和异丙基将变成直立键,并与直键烷氧基产生强的 1,3-二直键相互作用.在相应的半原酸酯中间体中,一种类似的情况也将出现;因而,化合物 74 和 75 可以按照相当于构象刚性的双环原酸酯 76 来考虑.因此,使用化合物 74、75 和 76 所得到的结果证实了上面的结论,即构象刚性的原酸酯应该只生成羟基酯产物.
从化合物 72 和 73 得到的结果表明,在构象易变的原酸酯的水解中,羟基酯仍然是主要产物,但也形成一定量的内酯.这样就可以得到结论:每当四面体中间体以构象体 66—71 的混合物存在时,E 酯的形成(来自 69、70 或71)就能够在某些程度上与 Z 酯的形成(来自 66 或 69)相竞争(由于熵因素).
双环原酸酯 71-80 带有不同的两个烷氧基因,通过对它们酸性水解的研究,得到了有关这一过程的更为精确的信息.每个原酸酯都通过直键烷氧基的离去,产生单独的一个羟基酸酯.这样,71、78 和 79 生成同一个羟基酸甲酯81,而原酸酯 80 给出羟基酸乙酯 82.我们已经描述过它的逆过程,即在碱性条件下,烷氧负离子对相应双环内酯鎓盐的加成.它们表现出相同的专一性.
这些结果说明,构象体 F 肯定没有参与水解反应的过程.例如,如果用立体电子原理对构象体 F,即原酸酯 78 的构象体 83 进行考察,它一定产生两
个羟基酸酯 81 和 82 的混合物.事实上,构象体 83 必定首先产生开链的二烷氧基碳正离子 84,84 经水合之后即给出非环的四面体中间体 85 和 86.由于在 85 和 86 中允许分子内的转动,然后给出一系列不同的构象体,这些构象
体应该碎裂给出羟基酯 81 和 82 的混合物.
在研究顺式和反式双环原酸酯 87 和 88 的温和酸水解的过程中,观察到
一个有趣的实验结果.在动力学控制的条件下,顺式原酸酯 87 生成了二羟基酸甲酯 89,而在同样的实验条件下,反式原酸酯 88 却直接产生了羟基-内酯90.这些结果可根据立体电子控制原理来解释.
顺式双环原酸酯 87 可以两种不同的构象 91 和 92 存在.构象 92 对应于不活泼的三环原酸酯 62 的构象,即构象体 C,因而它可以排除掉.在立体电子控制下,构象体 91 可以发生直立 C—O 键的断裂,生成内酯鎓离子 93,93 经水合之后给出半原酸酯 94.在 94 中,椅式的转换是不利的,这是因为转换将使羟基烷基侧链采取直键的取向,因而可以预测,94 将趋于生成二羟基酸甲酯 89.
反式双环原酸酯 88 一定以构象 95 存在,初级立体电子效应只允许甲氧基的离去,产生双环内酯鎓离子 96,又经水合(→97)和断裂之后,即只给出单一的羟基-内酯 90.97→90 的过程不能在立体电子控制下发生,因而它的能垒一定比在其它情况下的高.Kaloustian 和 Khouri 已经证明,双环盐 96 和甲醇钠反应,专一地生成正式原酸酯 95.
King 和 Allbutt 已经描述了反式十氢合萘衍生的二氧五环碳正离子 98 的立体选择性水解.在温和的酸性条件下,98 水解生成几乎全部是直键酯产物 99,只伴随有微量(<0.5%)的平键酯 100.使用温和的碱性条件,得到了类似的结果.通过平衡研究,作者进一步确定,平键酯 100 是最稳定的异构
体,这说明直键异构体 99 的形成是受动力学而不是热力学控制的.使用由甾族化合物衍生的其它两个二氧五环碳正离子,获得了基本一致的结果.
这些作者也进行了原酸酯 101 的水解反应.当 R=CH3、C2H5 或 C6H5 时,几乎专一地形成了直键酯 99,而不形成平键酯 100.当 R=H 时,在动力学控制的条件下,他们得到了 60%的直键酯和 40%的平键酯的混合物.原酸酯 101
(R=CH3、C2H5 或 C6H5)产生和二氧五环碳正离子盐 98 相同的结果,这并不
奇怪,因为 98 被认为是 101 水解过程中的一个中间体.其他研究者也观察到
形成直键酯大于形成平键酯的倾向.
King 和 Allbutt 已经对他们的结果进行了解释,或者是由于在相应的半原酸酯中,平键氧的优先被质子化的原因,或者是由于立体因素和立体电子因素的结合的原因.这两种解释很可能都是合理的,因为平键氧的质子化比较容易进行是立体电子效应的直接结果(它使平键氧原子具有较强的碱性). 应该进一步指出,是这些研究者最先报道立体电子效应可能在水解反应中起作用的.然而他们对立体电子控制原理的普遍性和重要性并没有充分的认识.根据现有的理论,这些反应可用下面的方式来解释.由于二氧五环碳正离
子基本上呈平面结构,所以碳正离子 98 的椅式 B 环一定是被扭曲而趋向于半椅式的.在立体电子控制下,98 的水合一定从α面发生,给出半椅式的半原酸酯 102(图 8),由于进入的水分子与 B 环之间的空间阻碍,必定抑制了半原酸酯 103 的形成.半原酸酯 102 一旦形成,它就可以来取构象 104 或 105, 由此即解除了由B 环的半椅式引起的张力.构象体104 和 105 可以在初级电子效应的帮助下分解,分别生成直键酯 99 和平键酯 100.
105 中的 R 基团与 B 环的一个亚甲基处于 1,3-二直键的排列(见:箭头).这样,当 R 是一个大基团时,构象体 104 将比 105 占优势,直键酯将优先形成;但当 R 是氢原子时,104 和 105 则以一个平衡混合物存在,并形成直键酯 99 和平键酯 100 的混合物.这基本上是King 和Allbutt 所持的立体和立体电子的论据.优先形成直键酯的另外一个原因,是 104 断裂生成的直键酯具有Z 构象 106,而 105 的断裂将形成一个平键酯 107,它具有不太稳定的 E 构象.
