-
双键的形成
- E2 和 ElcB 反应
我们在第五章已经讨论过,从碳正离子形成双键,要求邻近的碳上的 C
—H 键与碳正离子的 p 轨道平行.在这一章,我们不再进一步讨论这个问题, 而是讨论碱性条件下的双键形成.
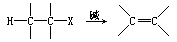
原则上,在碱促的消除 HX 形成双键的反应中,立体电子效应应该起重要的作用.这个反应可以通过一个分步机制或协同机制进行.在非协同机制
(ElcB)中,C—H 键的断裂发生在 C—X 键的断裂之前.这样,根据 283 中电子对与 C—X 键的相对取向,应该能观察到强的立体电子效应.实际上,当电子对与 C—X 键处于反式共平面时,应该使双键的形成变得容易.
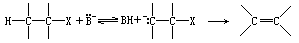
在这个基础上,大量的实验结果得到了解释.例如,化合物 284 通过一个反式过程,只给出烯烃 286,而其异构体 285 却给出烯烃 286(顺式方式)和287(反式方式)的混合物.
Bartsch 和 Závada 对这一结果作了清楚的解释.下面是引自他们最近关于烯形成的 E2 和 ElcB 消除反应的综述文章的两段论述.
“从赤式底物 284 中提取质子,导致了棱锥形碳负离子 288—290 的快速
平衡混合物.而消除过程只通过碳负离子 288 进行,因为它的电子对处于排斥离去基团的理想位置,同时在碳负离子 288 中,Ar-ArSO2 受到的立体相互作用最小.因此发生了单一的反式消除.”
“在苏式化合物 285 的消除反应中的情况却不相同,因为立体电子因素和构象因素不协调.由于对立体电子有利的碳负离子 291 受到严重的 Ar- ArSO2 立体相互作用的干扰,而使其排斥离去基团的作用变得困难,所以反式消除被减慢,而通过碳负离子的顺式消除变得具有竞争力了.”
他们进一步指出,从 292 和 293 进行的顺式消除,有可能要求碳负离子发生构型反转,以便使电子对变成与离去基团处于反式共平面的取向.
在协同机制(E2)中,C—H 键和 C—X 键通过一个单一的过渡态(294) 同时发生断裂.不过,协同的 1,2-消除取决于 C—H 和 C—X 键之间的二面角θ,这两个键将在活化复合物中断裂.用刚性体系进行的实验表明,消除反应的活化能有两个极小值,它们分别对应于消除基团处于反式共平面(θ=180
°,见 295)和顺式共平面(θ=0°,见 296)的排列.这有力地显示,立体电子效应在这一反应中起着重要的作用.
在构象易变的体系中,反式和顺式消除在理论上都是可能的.反式消除在电子上应该比顺式消除有利,因为 C—H 键的电子对与离去基团处于反式共平面.也有人提出,顺式消除可能需要在 C—H 键上发生一个构型反转,于是这个键的电子对可以变得与 C—X 键处于反式共平面了(297→298).
看来,得出这样的结论是可靠的:在只有立体电子效应起作用的情况下,
反式消除过程比顺式消除过程有利.但是还有其它几个重要的因素,如亲核试剂效应、溶剂效应、底物的烷基结构以及离去基团的性质.这些可变因素中的任何一种都能使协同消除反应的立体化学过程完全发生逆转.
处于羰基β位的离去基团,其离去而产生α,β -不饱和体系的立体化学要求已在前面论述过了(见 6.1.3 节).在这里可以指出,通过环丙烷环开环形成双键的过程,也应该遵循同样的立体电子原理.在酸性条件下,β,γ- 环丙基-δ-羟基酮 299 平稳地转化成二烯酮 300 的反应,是这种反应的一个例子.
Julia 及其同事们发展了一种合成高烯丙基溴化物的新颖方法,即用氢溴酸处理环丙基甲醇,使之发生重排.例如,二级的环丙基甲醇 301 可以 90
—95%的立体选择性转化成反式-溴代烯烃 302.
Newman 投影式 304 和 305 阐明了协同过程所要求的过渡态的几何形状, 它们分别生成反式和顺式溴代烯烃 302 和 303.分子模型表明,305 中的 C1 和C3 两个亚甲基与 R 基团之间存在着严重的非键立体相互作用,这使得 305 不如 304 稳定.因而,反式烯 302(得自 304)的优先形成容易得到解释.
在一个改进的 Julia 过程中,Johnson 及其同事们证明,在乙醚中,用无水溴化锌处理环丙基溴化物(301,OH=Br),平稳地给出反式-高烯丙基溴化物 302,只有微量的顺式异构体 303 形成.这个结果可以用立体的和立体电子的证据结合起来解释,如上面所讨论的那样.
