第七章 有关三键的反应
亲核试剂 Y 对三键(如 1)可以发生加成,生成一个产物负离子,其中进入的亲核试剂与非键电子对处于反式(2)或顺式(3).因而立体电子效应应该影响产物的形成.
Ingold 曾经提到,在早期文献中所包含的几个观察结果表明,对于生成炔属化合物的消除反应,存在着立体化学有利和立体化学不利两种情况.例如Michael 发现,氯代富马酸(4)被碱转化成丁炔二酸(6)的速度比氯代马来酸(5)大约快 50 倍.Cho-vanne 观察到,顺-二氯乙烯(7)被碱转化为氯代乙炔(9)的速度比反-二氯乙烯(8)大约快 20 倍.
Cristol 及其同事们发现,在乙醇钠乙醇溶液的存在下,对顺-对硝基苯乙烯溴化物 10 进行消除反应(产生 11),要比反式异构体 12 进行另一种反
应(→13)快 2300 倍.
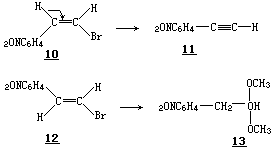
Modena 及其同事们也报道了顺-β-芳基磺酰基乙烯基氯化物(14)发生的甲氧负离子对卤素的亲核取代.反应经过一次 E2 反式-消除生成乙炔衍生物(15),随后进行一个反式加成,而产生顺式产物 16.
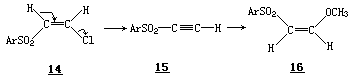
据 Miller 报道,甲氧负离子催化的甲醇对苯乙炔(17)的加成,经过中间体 18,立体专一地给出顺-β-甲氧基苯乙烯(19).
Truce 和他的同事们的研究表明,在乙醇钠存在的情况下,顺-二氯乙烯20 很容易与对甲苯硫酚钠反应,生成顺-1,2-二(对甲苯巯基)乙烯 22;而
反式异构体 21 在相同的条件下反应时,却保持不变而被回收.现已得到一些令人信服的证据证明其转化 20→22 是经过中间体 23、 24 和 25 进行的. Truce 和 Simms 也观察到,对甲苯硫酚对苯乙炔和 2-丁炔的碱催化加成反应分别产生顺-苯乙烯基对甲苯基硫醚(26)和 2-对甲苯硫基-反-2-丁烯(27).
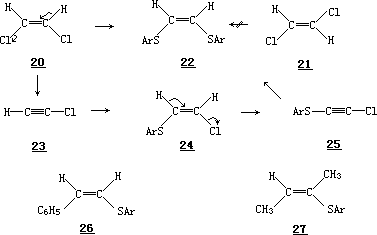
因而反式消除反应在立体化学上明显地比顺式消除有利,这表明立体电子效应在这些反应中必定起着决定性的作用.Ingold 已经指出:
“⋯⋯在一个异裂的消除反应中,包含着一个内部的在α-碳原子上的SN2 类型的取代反应.由于受不相容原理的限制,在该碳原上接受新电子对的一侧必须远离被排斥的旧电子对的一侧.与这个过程同步,在β-碳原子上同时发生一个 SE2 类型的取代反应.对于这样的一个取代反应,不能期望它的立体化学是受任何无可更改的原理制约的.然而在这一类型的取代反应中,经常可以观察到:进入交换的电子对交换核而不改变构型,这 是协同反应的特性, 并且如 28 所示,导致反式的消除反应.但是,如果在过渡态中,进入交换的
电子对能充分脱离离去的质子的话,则此电子对,如 29 所示,便能穿过β- 碳原子,然后通过取代反应进入α-碳原子,而发生顺式的消除反应.”
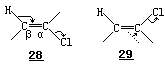
最近, Hegarty 研究了腈盐离子 30 的反应性,他发现在动力学控制的条件上,在形成的产物中,氮的电子对总是与进入的亲核试剂处于反式即 31. 在一篇精彩的综述中,Hegarty 介绍过下述情况,即:尽管进行了仔细的探索,他们仍未能观察到任何可检测量的顺式产物 32(或者是通过进一步的化学转化从 32 衍生出的产物).
例如,在腙溴化物 33 的溶剂解中形成的 N-苯胺基腈盐离子 34,在 30℃ 和乙酸钠存在的情况下,即定量地给出 Z-O-乙酰基异酰胺 35.此 Z 异构体 35 经加热即生成 E 异构体 36,后者迅速地转化成相应的酰胺 37.
在另一个例子中,酰胺肟 38 的重氮化反应,即生成腈盐离子 39,随即被乙酸根离子捕捉,成为 Z 异构体 40.
羧酸根离子与腈盐离子反应的速度比胺与腈盐离子反应的速度快得多, 而且只生成 Z-O-酰基异酰胺,这一观察导致了一种合成肽的新方法的发展. 亚胺卤化物 41 溶解在一种极性溶剂中,经过迅速的单分子电离,生成腈盐离子 42,它与羧酸根离子反应生成 Z-O-酰基异酰胺 43,随后 43 与胺反应,生成酰胺产物 44.酰胺(或肽)的形成可以这样来完成,即把卤化物 41 加入到一个含有胺和羧酸的溶液里.在 pH=6 时,起初的几个反应(41→42→43)可
以很好地完成;而当 pH 值调到大约为 8 时,酰胺的形成(43→44)既迅速又完全.一个重要的特征是:由于中间体 Z-O-酰基异酰胺 43 的几何形状,它对于 O-N 酰基迁移是稳定的.
Hegarty及其同事们也发现,许许多多的亲核试剂(Y = Cl - ,N- ,CH O
3 3
- ,R—C≡C- ,R 2 N&&H,CH 3COO - 和AlH- )对苄腈氧化物45的加成完全
是立体专一的,产生反式加成物 46.
Hegarty 和 Chandler 发现,在有 AgCl 存在和较低的温度下,二级胺和异腈 47 反应,即生成可分离的但热力学不稳定的 Z-脒 50.这一反应被认为是经过金属化的腈盐中间体 48 的形成而发生的,二级胺对 48 进行立体专一的加成,生成化合物 49.而后化合物 49 转化为 Z 异构体 50.
在亲核试剂对腈盐离子加成中观察到的显著的立体专一性,也应该表现在其逆过程中,即失去一个原子或基因而导致腈盐离子形成的过程中. Johnson 及其同事们制备了若干对异构的O-烷基异羟肟酰氯 51 和 52.在剧烈的条件下,这些化合物经过失去氯离子的单分子反应,即生成腈盐离子 53, 并且发现 Z 异构体 51 远比 E 异构体 52 活泼(KZ/KE≈450).而且在用申醇捕捉腈盐离子 53 的情况下,两个氯化物都产生单一的产物 Z 异构体 54.
Broxton 也观察到,芳基重氮盐离子 57 的形成,使用 Z 异构体 55 比使用 E 异构体 56 速度快得多(≈104).
亲核试剂对雷酸(58)和乙腈氧化物(59)加成的理论研究也已进行过. 从头算起的计算表明,这些化合物在基态是线性的,但它们比较容易变形. 在腈盐体系中的原子被弯曲成反式的方式比弯曲成顺式的方式明显地容易得多.当亲核试剂与腈氧化物反应时,能较早地到达其过渡态,构型相当于 60. 这样,产物的构型在过渡态的阶段就已明显地确定了.
还有 Procter、Britton 和 Dunitz 的工作.他们用 X 射线分析测定了 8- 甲氧基-1-萘腈和 8-硝基-1-萘腈的晶体结构.甲氧基衍生物的结构对应于61,其中环外 C—O 键向内弯曲(朝向氰基),环外 C—CN 键向外弯曲(背离甲氧基).C—C≡N 键角是 174°而不是 180°.从 8-硝基-1-萘腈得到了类似的结果.这一化合物的晶体包含两个对称的独立分子,它们在结构上是有差别的.两个结构都显示出一个弯曲的 C—CN 键和一个短的 O⋯C≡N 距离(参见62).但是硝基的取向不同,其中一个分子的 O1⋯C11 距离是 2.69Å,而另一个是 2.79Å.这一分析与理论计算和上述的实验结果完全一致.这样可以得出如下结论:亲核试剂对三键的加成(及其逆过程)是强烈地受立体电子效应影响的,这一效应有利于反式方式的加成.
Beckman 重排使肟(及其衍生物)转化成酰胺.在这一重排中,迁移的基团是与 N—O 键处于反式共平面的那个基团,而且迁移基团的立体构型保持不变(参见 63→66).这样 R1 基团优先于 R2 基团迁移,通过 64 首先形成腈盐
离子 65.腈盐离子 65 发生水合,随后进行互变异构,给出酰胺 66.当可能迁移的基团能够形成相对稳定的碳鎓离子时,则发生碎裂反应(67→68), 产生相应的腈而不发生迁移反应.
Eschenmoser 和他的同事们研究了碱引发的α,β-环氧-甲苯磺酰腙的碎裂过程,反应生成炔酮(即 69→71).令人感兴趣的是,在这一碎裂中, 三键和分子氮均从重要的中间体 70 经过反式方式产生.硝基苯并异噁唑羧酸盐(72)脱羧生成 2-氰基-5-硝基苯酚(73),也可看作是反式消除.
在酰基叠氮化物的 Curtius 重排中,产生了作为初产物的异氰酸酯(74
→75)和分子氮,迁移基团和在 Beckman 重排中一样,保持它的立体化学构型.因而很有可能立体电子效应控制着这个重排,并且R—C键一定与N—N
- 键处于反式共平面(76→77).应予以注意的是,76 中的氧原子有一电子对与迁移的 R 基因处于反式共平面.
