《乙烯的性质和用途》教案设计
【课题】乙烯的性质和用途
【教学目的】使学生掌握乙烯的化学性质和用途;使学生进一步明确分
子结构与性质的辩证关系;培养学生观察能力、思维能力、分析问题和解决问题的能力。
【教学重点】乙烯的化学性质。
【教学难点】乙烯的加成反应。
【教学方法】以实验为中心的发现法。
【教学过程】
(一)复习
实验室制取乙烯的原理:
酒精与浓硫酸的体积比是 1∶3 浓硫酸既作催化剂,又作脱水剂。温度控制在 170℃。反应混和液中放碎瓷片的作用是防止暴沸。
(二)授新课1.物理性质
[展示样品]让学生观察乙烯的颜色、状态,并嗅气味,小结物理性质。板书:无色气体,稍有气味,密度是 1.25 克/升,比空气略轻(分子量
28),难溶于水(排水法收集乙烯)。
实验表明,乙烯是一种不饱和烃,分子里的两个碳原子和四个氢原子都处于同一平面。
从键能知道,C=C 双键的键能并不是 C→C 单键键能的两倍,而是比两倍略少。说明双键里其中一个键容易断裂,能跟其它原子或原子团结合。
这节课将从乙烯的化学性质证实乙烯中 C=C 双键的性质不同于乙烷中的C→C 单键。
- 化学性质
乙烯与溴水的加成反应,演示实验 4—6。观察溴水颜色褪去,能鉴别乙烯。
简述:乙烯分子在溴的攻击下,C=C 双键里的其中一个键容易断裂,同样溴分子在乙烯的作用下,Br—Br 键也会逐渐断裂,两个溴原子分别与两个不饱和的碳原子结合,生成 1,2 一二溴乙烷。乙烯分子里的双键中一个容易断裂,两个溴原子分别加在两个价键不饱和的碳原子上,象这样的反应叫做加成反应。
①加成反应
师生共同小结给出定义:有机物分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应,叫做加成反应。
CH2=CH2+Br2→BrCH2→CH2Br
简述:乙烯和乙烷都能与溴反应生成相同的产物 1,2 一二溴乙烷。乙烷与纯溴在光照条件下,发生的是取代反应,产物是一种混和物;而乙烷与溴水在常温下发生加成反应,产物是单一的。
 常见的加成试剂有:H2、HCl、H2O
等等。学生练习:
常见的加成试剂有:H2、HCl、H2O
等等。学生练习:
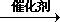
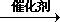 CH2=CH2+H2
CH2=CH2+HCl
CH2=CH2+H2
CH2=CH2+HCl
CH2=CH2+H2O
小结:乙烯的加成反应在实质上是 C=C 双键容易断裂,能够分别与其它
的原子或原子团结合成新的共价键,说明乙烯的化学性质比乙烷活泼。
②氧化反应
乙烯在空气中燃烧,演示实验 4—7。
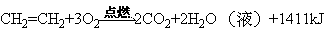
观察现象:火焰明亮,有黑烟生成。说明含碳量较大,部分碳没有充分燃烧。
有水生成(火焰的上方罩一干燥表面皿观察)。
有二氧化碳气体生成(用附有氢氧化钙液滴的表面皿观察)。乙烯不但能发生上述氧化反应,也可能被其它氧化剂氧化。 乙烯能使酸性高猛酸钾溶液褪色,演示实验 4—8。
乙烯被氧化,而高猛酸钾被还原。另外,乙烯还能进行催化氧化等等。2CH2=CH2+O2 2CH3CHO
2CH3CHO
乙醛
说明乙稀具有还原性。
③聚合反应
在适当的温度、压强和催化剂条件下,乙烯双键里的一个键全断裂,分子里的碳原子能互相结合成为很长的链。
这种聚合反应也是加成反应,简称加聚反应。指导学生看书 P.76 中段。小结;由于乙烯分子里的 C=C 双键里的一个键容易断裂,能跟其它原子
或原子团直接结合,因此,乙烯的化学性质比乙烷活泼,能发生加成、加聚和氧化反应,另外从乙烯的活泼性和还原性也充分说明乙烯是含有双键的不饱和烃。
- 用途
乙烯在工业上用于制造塑料、合成纤维、有机溶剂。
乙烯生产的发展带动了其它石油化工基础原料和产品的发展,因此,常把乙烯的产量作为衡量一个国家石油化工发展水平的标志。
乙烯在农业上是一种植物生长调节剂,也可用作果实的催熟剂。乙烯在日常生活中用作制食品袋等。
思考题:课本 P.76 第 1、2 题作业:课本 P.76 第 3、4 题
