《钠》教案设计
【教学目的】 1.使学生掌握钠的重要性质,认识钠是一种活泼的金属。
2.通过有关钠的性质实验,培养学生的观察能力和分析问题的能力。
【教学重点】钠的化学性质
【教具】(略)
【药品】(略)
【教法】引导、探索、归纳教学法
【教学过程】以演示趣味实验——滴水生火开始,在蒸发皿中放入少量乙醚和一小块金属钠,然后滴入几滴水,学生马上看到了异常现象,将水滴入后立即燃烧起来,这是为什么呢?激起了学生探求新知识的欲望,引入新课教学。
-
学生观察金属钠的颜色、状态。
-
教师指导学生动手做钠跟水反应的实验,引导学生观察并思考。
①钠呈银白色光泽,又可用小刀割开,说明什么问题?
②钠粒投入水中浮游水面,熔成小球,为什么?
③产生气体(有时会燃烧),这是什么气体,钠粒渐渐变小,最后为什么消失了?
④反应的溶液中滴入几滴酚酞试液,溶液呈红色,说明生成了什么性质的物质?
引导学生自然地得出结论:
钠呈银白色、质软、密度比水小、熔点低,与水剧烈反应,生成氢气和氢氧化钠。
- 教师演示: 钠跟水的反应:
指导学生书写反应的化学方程式:
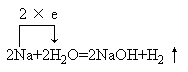
指导学生书写反应的离子方程式: 2Na+2H2O=2Na++2OH-+H2↑
- 教师演示:
钠与氧气反应,因反应条件不同可生成不同的氧化物。
①钠在常温下与氧气反应
操作:常温下在空气中切割金属钠
现象:银白色光亮断面渐成暗的灰白色
结论:生成氧化钠,钠在常温下易氧化反应方程式:
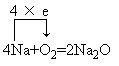
所以,钠应保存在煤油或液体石蜡中,使之与空气和水隔绝。
②钠在空气中燃烧
操作:在空气中加热钠使钠熔化。
现象:钠燃烧,火焰呈黄色,生成淡黄色固体。结论:生成过氧化钠。
反应方程式:
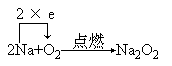
指出:钠在空气或氧气中燃烧,生成过氧化钠,钠除了能与氧气氯气直接化合外,还能与其它许多非金属单质直接化合,如与硫化合生成硫化钠。
反应方程式:
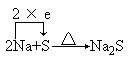
结论:钠在上述反应中,均失去电子被氧化,所以钠是一种活泼金属, 是还原剂,具有强还原性。
- 根据钠的性质,引导学生归纳钠的存在和用途。
-
钠的存在:以化合态存在于自然界。存在形式:NaCl、Na2SO4、Na2CO3、NaNO3
-
钠的用途:①制取 Na2O2;②做原子反应堆导热剂;③做还原剂;
④用于电光源,制高压钠灯6·练习与思考:
钠与硫酸铜溶液反应能否置换出单质铜? 教师演示:金属钠与硫酸铜溶液反应。
学生观察现象并观看金属钠与其它盐溶液反应的录像。
最后教师指出:金属钠与可溶性盐溶液反应,不是简单的置换反应: 7.简单小结本节内容,指导学生填写学习提纲检查填写情况。
8.布置作业:
教材 P.85、1、2、3 学习提纲
钠 1.钠的物理性质,存在和用途
- 物理性质
钠是 色,质地 的轻金属,是 和 的良导体。
- 存在:
不能以 态存在,只以 态存在,主要以 的形式存在,也以
、 、 等存在。
- 用途:①制 ;②做 Na-K 合金是 ;③做还原剂, 可把
从它们的卤化物里还原出来;④用在电光源上,制 灯。
2.钠的化学性质:
钠的化学性质活泼,是很强的还原剂,通常保存在 中。
- 钠与氧气反应;常温下在空气中易被氧化为 ,由于其不稳定, 继续被氧化为 ,化学方程式为 和 。
钢在空气中燃烧时生成 ,火焰颜色为 ,产物为 色, 其化学方程式为 ,产物中氧元素的化合价为 。
- 钠与水的反应: 化学方程式为 离子方程式为 现象 解释
①浮在水面上:
②熔成小球:
③向各个方向迅速游动并发出嘶嘶声:
④钠粒逐渐变小最后完全消失:
⑤溶液滴加酚酞变成红色:
- 钠与盐溶液反应
将一小块钠投入 CuSO4 溶液中除观察到 外,还观察到 ,所发生的化学反应为 , ,
该反应总的化学方程式为 , 。
