第三节 根据化学方程式的计算
化学方程式不仅表示什么物质参加反应,反应后生成什么物质,还表示反应物、生成物各物质之间的质量比。因此,可以根据化学方程式计算用一定量的原料最多可生产出多少产品;制备一定量的产品最少需要多少原料等。通过计算,可以加强实验和生产的计划性,合理地利用资源。
现举例说明根据化学方程式进行计算的一般步骤。
**【例题 1】**在实验室里用氢气还原氧化铜制取铜。若制取 2.0g 铜,需要氧化铜的质量是多少?
解:(1)设未知量
设制取 2.0g 铜需要氧化铜的质量为 x。
 写出有关反应的化学方程式
写出有关反应的化学方程式
CuO+H2 Cu+H2O
- 写出相关物质的式量,并在其下面对应写出已知量、未知量
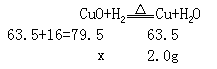
- 列比例式并求解
79.5 = x
63.5 2.0g
x = 79.5×2.0g = 2.5g
63.5
- 简明地写出答案
答:用氢气还原氧化铜制取 2.0g 铜,需要氧化铜 2.5g。
在实际的解题过程中,[例题 1]中说明步骤的文字可以不写。实际解题可参照[例题 2]的格式。
**【例题 2】**用 39g 锌与足量的稀硫酸反应,能够制得氢气的质量是多少? 解:设能制得氢气的质量为 x。
Zn + H2 SO4 = ZnSO4 + H 2 ↑
65 2
39g x
65 = 39
2 x
x = 39g×2 = 1.2g
65
答:能制得氢气 1.2g。
**【例题 3】**煅烧含杂质 10.0%的石灰石(主要成分是 CaCO3)50.0t, 可制得生石灰(CaO)的质量是多少?
解:50.0t 石灰石含杂质为 50.0t×10.0%=5.00t,含 CaCO3 为 50.0t-
5.00t=45.0t。
设煅烧 45.0tCaCO3 可制得生石灰的质量为 x。
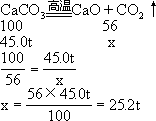
答:可制得生石灰 25.2t。
