复 习 题A
1.将正确答案的序号填入括号内
-
下列各组中的物质都能电离的是 [ ]
-
稀硫酸、食盐、硝酸钾
-
铁、氢氧化钠、硫酸钾
-
氯化铵、酒精、烧碱
-
氯化镁、消石灰、纯碱
-
-
下列物质中有自由移动的氯离子的是 [ ]
-
氯化钠晶体
-
熔融氯化钾
-
氯酸钾溶液
-
液态氯化氢
- 下列电离方程式中,正确的是 [ ]
(A)Ba(OH)2=Ba2++(OH)-2
(B)H2SO4=H++SO2-
(C)K2CO3=2K++CO2-
(D)Cu(NO3)2=Cu+2+2NO-3
- 在测定溶液导电性的装置中盛有硫酸铜溶液,通电时灯泡发亮,
若不断加入某物质,发现灯光变暗,直至熄灭,再继续加入该物质,灯泡又发亮,则加入的物质是 [ ]
(A)KOH 溶液
-
Zn 粒
-
BaCl2 溶液
-
Ba(OH)2 溶液
- 用托盘天平称量苛性钠时,药品应放在 [ ]
①烧杯中②洁净的纸上③左盘上④右盘上
-
①和②
-
②和④
-
①、②和③
-
①和③
- 分别盛有浓硫酸和浓盐酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),则两瓶溶液的
[ ]
-
质量都变小了
-
溶质的质量分数都变大了
-
体积都变小了
-
溶质的质量分数都变小了
- 往密闭容器里通入 CO 和 O2 的混合气体,其中含有 a 个 CO 分子和b个 O2
分子,使其反应后,容器内碳原子数和氧原子数之比为
[ ]
- a
b a
- 2b
a
-
2(a + b)
-
(D)
a
a + 2b
- 下列反应中氧化物发生了还原反应的是 [ ]
(A)CuO+2HCl=CuCl2+H2O
 (B)C+CO2
2CO
(B)C+CO2
2CO
 (C)3H2+WO3
W+3H2O
(C)3H2+WO3
W+3H2O
(D)CO2+2NaOH=Na2CO3+H2O
- 能用来鉴别稀硫酸、纯水、澄清石灰水三瓶溶液的一组试剂是
[ ]
①pH 试纸②酚酞试液③稀盐酸④碳酸钠溶液⑤石蕊试液
(A)①②③
(B)③④⑤
(C)②③④
(D)①④⑤
- 下列各组物质相互反应,反应后溶液总质量比反应前溶液总质量减轻的是 [
]
①Mg 和稀 H2SO4 完全反应②CuO 和稀盐酸完全反应③Na2CO3 溶液和澄清石灰水完全反应④NaOH 溶液和稀 H2SO4 完全反应⑤Fe 和 CuSO4 溶液完全反应
-
①和②
-
②和③
-
③和④
-
③和⑤
- 现有试剂:①蒸馏水、②硝酸银、③氯化钡溶液、④稀硝酸。要检验某硝酸银固体是否含有少量可溶性盐酸盐杂质,应选用上述试剂中的
[ ]
-
①和④
-
②和④
-
①、②和④
-
①、③和④
- 分离 FeCl3、KCl、BaSO4 的混合物,在不引入新杂质的情况下,
应采用的一组试剂是 [ ]
-
水、硝酸银、稀硝酸
-
水、氢氧化钠、盐酸
-
水、氢氧化钾、盐酸
-
水、氢氧化钾、稀硝酸
|
(13)下列置换反应的化学方程式正确的是 |
[ |
] |
|---|---|---|
|
①Cu+2HCl=CuCl2+H2↑ |
||
|
②Fe+MgCl2=FeCl2+Mg |
||
|
③Mg+2HNO3=Mg(NO3)2+H2↑ |
||
|
④2Fe+6HCl=2FeCl3+3H2↑ |
||
|
⑤Cu+Hg(NO3)2=Cu(NO3)2+Hg |
-
②③
-
①④
-
④
-
⑤
- 下列各组物质,由金属跟同一种酸直接作用生成的是 [ ]
(A)ZnSO4 和 Al2(SO4)3
(B)K2SO4 和 Na2SO3
-
FeCl2 和 FeCl3
-
MgCl2 和 CuCl2
- 下列物质与水发生化合反应,且所得溶液的 pH 小于 7 的是
[ ]
(A)SO2
(B)SiO2
(C)CaO
(D)HCl
-
某氢氧化钠溶液中,钠离子和水分子个数比为
1∶20,则该溶液中溶质的质量分数为 [ ]
-
0%
-
0%
-
(C)4.8%
(D)6.0%
- 等质量、等溶质质量分数的稀盐酸分别与足量锌、铁、铝反应,
按上述顺序,得到氢气的质量比是 [ ]
(A)1∶1∶3
(B)2∶2∶3
(C)1∶1∶1
(D)1∶1∶2 2.填写下列空白
-
钡餐透视肠胃疾病时,让病人口服硫酸钡,但若误服碳酸钡就会中毒。已知可溶性钡盐有毒,上述中毒的原因是(用化学方程式回答) 。误服碳酸钡可立即服用硫酸镁来解毒。原因是(用化学方程式回答) 。
-
在空气中久置的烧碱溶液,滴加盐酸后,可看到 的现象,所发生反应的化学方程式为 。
-
在①石灰石、②盐酸、③熟石灰、④液态氢、⑤碳酸氢钠溶液、
⑥液态氧、⑦苛性钠等物质中,能使某些金属除锈的是(以下都填上述物质的标号) ;能用作航天工业高能燃料的是 ;能浸渍多孔木屑制成炸药的是 ;农业上用于降低土壤酸性改进土壤结构的是 ;能制取生石灰或水泥的是 ;能用于肥皂、石油、造纸、印染等工业的是 ;能在
皮肤被浓酸灼伤时,作处理药剂的是 。
- 把 HCl、NaOH、NaCl、SO3 和 CaO 分别溶于水,并在水溶液中滴入数滴紫色石蕊试液。按下列要求填空:
①pH>7 的是 溶液,滴入石蕊试液后显 色。
②pH<7 的是 溶液,滴入石蕊试液后显 色。
③pH=7 的是 溶液,滴入石蕊试液后显 色。
- 某溶液含有硝酸铜、硝酸银、硝酸钡 3 种溶质,为使上述 3 种物质分别转为沉淀分离出来,现提供 Na2CO3 溶液、盐酸、NaOH 溶液 3 种试剂, 若要求每次只加 1 种试剂,滤出 1 种沉淀,那么所加试剂的顺序是:① 、
② 、③ 。
- 硝酸钾溶液中混有少量硫酸铜,如果只允许用 1 种试剂除去硫酸
铜,这种试剂可以选用 ,其反应的化学方程式为 。如果用 2 种试剂来除去硫酸铜,则可选用 。
- A、B、C3 种物质的水溶液都是无色透明的。依次取少量的 A、B、C 溶液,分别滴入紫色石蕊试液后,溶液的颜色分别为红色、蓝色、紫色; 将 A、B 两溶液混合,仅得到 C 溶液;往 A 溶液中滴入硝酸银溶液,生成不溶于稀硝酸的白色沉淀;C 是离子化合物,其中阳离子的结构示意图为

- 有一包白色粉末可能是①Ca(OH)2、②CaCO3、③Na2CO3、④BaCl2、
⑤Na2SO4 等 5 种物质中的 1 种或几种。取 0.50g 白色粉末放入 10mL 水中, 完全溶解,呈无色透明的溶液。然后滴加盐酸,有无色气体放出。
根据上述现象判断:该白色粉末中肯定存在的物质是 ,不可能存在的物质是 ,不一定存在的物质是 。
- 用化学方程式表示右下图关系中的各反应,并在括号中说明化学反应的基本类型。
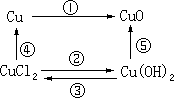 ①
( )
①
( )
② ( )
③ ( )
④ ( )
⑤ ( )
- 欲除去下列物质中含有的少量杂质,将除去杂质加入的试剂和方法的标号填入相应的答案栏里。(每个答案栏里只能填 1 个标号,每个标号只能
填写 1 次)
|
物质 |
杂质 答案 |
加入的试剂、方法 |
|---|---|---|
|
氯化锌 |
氯化铜 |
a 、加入适量盐酸,过滤 |
|
氯化钠 炭粉 |
碳酸钠 氧化铜 |
b 、加入适氢氧化钠溶液,过滤 c 、加入适量碳酸钠溶液,过滤 |
|
氢氧化钠 |
氢氧化钙 |
d 、加入适量盐酸 |
|
e 、加入适量锌粉,过滤 |
- 用铁、水、三氧化硫、氧化铜、氢氧化钙、氢氧化铁、碳酸钠、硝酸钾等物质中的某些物质以及它们的反应产物,按下列要求写出有关反应的化学方程式。
-
产生氢气的分解反应
-
分别有氧气和水参加的化合反应
-
氢气作还原剂的置换反应
-
碱和盐发生的复分解反应
- 一定温度下,15.0g 饱和氯化铜溶液跟足量烧碱溶液反应,可生成
4.90g 蓝色沉淀。求该温度下氯化铜的溶解度。
