化学中的因果关系
前面已经指出,因果律的一般公式可概括为: 如果 C 类条件实现,
则 E 类事件就会发生。
我们结合对化学反应的分析,首先研究条件集合 C。化学反应可以写成如下一般形式:
反应物 反应条件→ 产物
其中反应物可以是一种,也可以是两种或两种以上,化学中所说的反应条件,多种多样,如溶剂、温度、压力、时间、催化剂等。因果律中的条件集合 C,对化学反应来说,包括反应物和反应条件。
一个化学反应能否发生,首先与反应物本身的结构有关。从因果关系来看,反应物的结构是发生化学反应的内在根据。在两种或两种以上的物质发生反应的情况下,对所指的某种反应物而言,它的结构是发生反应的内在根据;同时,它又必须与另一种或几种反应物发生相互作用,化学反应才能发生。例如,酸必须与碱发生作用才能发生中和反应,具有氧化性的物质必须与具有还原性的物质作用才能发生氧化还原反应,等等。这时,所指的反应物与其他反应物一起形成了反应物体系。就这个反应物体系而言,反应物之间的关系是体系内部的关系。这种关系是条件集合 C 中的一个方面,它既不同于分子内部结构,也不同于反应条件,它是介于这两者之间的要素。许多化学反应还必须有适宜的反应条件。这样,条件集体 C 可以具体化为内部结构或内在根据,反应物之间相互作用和反应条件。后两个因素,即反应物之间的相互作用和反应条件,对特指的某种反应物而言,都是反应借以发生的环境,可以叫做环境条件,相对于环境条件,特指的反应物结构称为内在根据。在这里,我们将条件集合 C 划分成两个基本要素:内在根据和环境条件。
具有某种结构的物质在不同环境条件下,可以发生不同的反应。这表明这种物质具有发生不同反应的可能性,而哪种可能性变成现实性,取决于环境条件。例如,在氧化还原反应中,某种反应物究竟是氧化剂还是还原剂, 要由与其发生反应的物质的性质来决定。又例如,乙醇脱水,在不同温度、用不同催化剂发生的反应不同,180℃在 Al2O3 存在下生成乙烯,用浓 H2SO4 作催化剂 150℃生成醚。
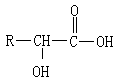 可是,反应的可能性取决于内在根据,即化合物的结构。例如,
至少有两种可能的反应方向,是因为它的结构有两种可能的
可是,反应的可能性取决于内在根据,即化合物的结构。例如,
至少有两种可能的反应方向,是因为它的结构有两种可能的
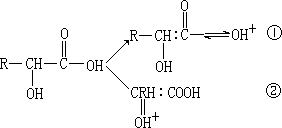 变化:
变化:
多官能团分子一般都有发生不同反应的可能性,而哪种可能性变成现实
性,要视环境条件而定。还以乙醇为例,用不同催化剂可以得到不同的产物, 也就是发生了不同的反应。参见下面的反应式:
-
Cu→ H CHO(乙醛) + H
-
Al2O3→ C H (乙醛) + H O
CH3CH2 OH
2 4 2
浓H2SO4
→(C2 H5 ) 2 O(乙醛) + H2 O
ZnO•Cr2O3→ CH
= CH − CH = CH2 (1.3 − 丁二烯)
划分内在根据和环境条件,不仅反映了化学因果关系中条件集合的特点,而且具有实践意义。化学家研究化学反应的目的,是为了认识化学反应的规律,用于指导实践。在实践中,化学家们总是希望化学反应朝着人们预期的方向进行,而且在这个方向上求得高效率,如高反应速率、高转化率等。为此,一方面分析反应物的结构,认识发生反应的可能性,另一方面还必须研究环境条件,找出适宜的条件和控制方法,以便使所希望的可能性变成现实性,并获得较高的收率。
划分内在根据和环境条件,还可以说明规律和规律的实现方式之间的关系,并从具体情况出发,找出规律发生作用的具体途径。规律是客观的,是不依人们的意志为转移的;但规律的实现方式是多样的,具有多种可能性。规律的实现方式不同,结果也就不同。规律的实现方式是可以选择、可以控制的,同一种规律由于选择了不同条件或设置了不同条件,实现方式不同, 结果也就不同。选择或设置不同条件,这是人的主观能动性的体现。物质分子的内部结构是内在根据,它决定着化学客体的存在,也决定着与该化学客体有关的化学反应,决定着化学反应的可能性,因而也就决定着化学反应的规律性。改变环境条件不改变规律的性质,却改变了规律借以实现的具体方式。环境条件本身也是客观的,改变环境条件就是改变客观事物之间的关系。如对某种反应物而言,选择与之发生作用的不同物质,其反应进行的方向可能不同,选择不同的催化剂,其反应进行的方式也不同,如此等等。改变, 包括取消一些,增加一些,或更换一些,更换实质上是取消和增加的结合。如同一条河流,增加一些,筑堤以阻止水的漫出;取消一些,清除河道中的阻碍物使河水畅流。取消和增加,改变了客观物质之间的关系。这些是人工可以办到的,是可以人为选择的,但是规律本身是不能改变的。人们不能让具有天然放射性的元素不放射射线,也不能让放射线不服从相应的规律。这就是规律与规律的实现方式的辩证法,是规律的客观性与发挥主观能动性的客观依据。
化学中的因果关系,具体表现形式是多种多样的,概括起来,有两种基本形式:因果链和交互作用。
化学中的因果链,原因引起结果,结果又作为原因引起新的结果。例如, NCl3 的光分解,首先使 NCl3 分子分解,需要消耗能量,产生自由基,自由基是反应的产物,是结果,它又成为原因,进一步使 NCl3 分解,产生 NCl2,不仅不再消耗能量,而且释放出能量,NCl2 又从结果转化为原因,与 NCl3 发生反应,即引起 NCl3 分解,产生三个 Cl 自由基。反应式如下:
NCl3 hv→ NCl2 +Cl—23千卡 / 摩尔
Cl+NCl3→Cl2+NCl2+34 千卡/摩尔
NCl2+NCl3→N2+Cl2+3Cl+35 千卡/摩尔
 化学中的交互作用。原因引起结果,结果又作用于原因,原因和结果发生交互作用。化学反应中的可逆反应,是交互作用的一个简单例子。在反应物
产物中,开始反应物发生作用生成产物,产物又成为反应物,它们发生作用又生成了它的产物(原来的反应物)。勒夏忒列原理表明,反应达到平衡以后,反应条件若发生变更,平衡向削弱或解除这种变更的方向移动。这就是说,条件的变更(原因)引起平衡移动(结果),平衡的移动(结果)
又削弱或解除了这种条件的变更(原因)。
化学中的交互作用。原因引起结果,结果又作用于原因,原因和结果发生交互作用。化学反应中的可逆反应,是交互作用的一个简单例子。在反应物
产物中,开始反应物发生作用生成产物,产物又成为反应物,它们发生作用又生成了它的产物(原来的反应物)。勒夏忒列原理表明,反应达到平衡以后,反应条件若发生变更,平衡向削弱或解除这种变更的方向移动。这就是说,条件的变更(原因)引起平衡移动(结果),平衡的移动(结果)
又削弱或解除了这种条件的变更(原因)。
自催化反应,如用微量高锰酸钾氧化草酸的反应,最初产生二价锰离子Mn2+,继之发生如下反应:
MnO- +Mn 2+ →MnO2- +Mn3+
4 4
C2O4H2+2Mn3+→H2O+2CO2+2Mn2+
- Mn2+不断地被转化成 Mn3+,Mn3+使草酸分子氧化又重新被转化成 Mn2+。在这种循环中,Mn2+开始表现为原因,它引起结果(Mn3+),Mn3+又反过来转 化成 Mn2+,结果本身变成了原因,而且变成了反应自身的原因。
化学振荡属于自催化反应。例如,溴酸盐和丙二酸的反应,其计量方程可以表示如下:
3BrO− + 5CH (COOH) + H + Ce3+·Ce4+→ 3BrCH (COOH)
- 2HCOOH
3 2 2 催化 2
+ 4CO2 + 5H2 O
 经研究发现,反应开始后,体系中生成
Br-,这是一种中间物;经过一段时间,中间物 Br-的浓度以及
Ce3+、Ce4+的浓度比呈周期性起落变化。如果略去对反应机理的详细分析,可以用下面的图式来表示:
经研究发现,反应开始后,体系中生成
Br-,这是一种中间物;经过一段时间,中间物 Br-的浓度以及
Ce3+、Ce4+的浓度比呈周期性起落变化。如果略去对反应机理的详细分析,可以用下面的图式来表示:
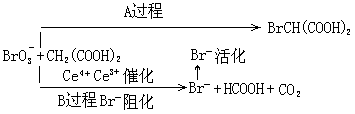
此图式表示的意思是:该反应中的两种反应物相互作用可以发生 A 过程,也可以发生 B 过程,究竟发生哪种过程,取决于 Br-的浓度,即受[Br-]的大小的控制。[Br-]有一个临界值,当[Br-]大于临界值时,发生 A 过程,在此过程中[Br-]下降;当[Br-]降至临界于值以下时,发生 B 过程,在此过程中, [Br-]逐渐上升,它阻化了 B 界于过程,[Br-]上升到临界值以上,又发生 A 过程。A、B 过程交替进 B 界于行,使中间物[Br-]与 HBrO2 的浓度及催化剂Ce4+和 Ce3+浓度比产生周期性升降,形成了化学振荡现象。①。
这个反应过程说明了什么呢?这个反应过程说明,[Br-]大于缺融临界值,作为一种原因,引起 A 过程(结果),A 过程的进行(结果)又使[Br-] 下降,即反作用于原因;当[Br-]下降到临界值以下,引谄養过程,这说明[Br-] 的值(即低于临界值的浓度值)又是引起,引贐过程的原因,B 过程是原因引起的结果,B 过程的进行又反作用于原因,使[Br-]上升。这样,[Br-]的上
① 详见李大珍:《化学动力学基础》,北京师范大学出版社,1989 年版,第 90—94 页。
升和下降,分别是引起 A ◻过程和 B 过程的原因,A 过程和 B 过程的进行又反作用于它们各自的原因,A 过程使[Br-]下降,B 过程使[Br-]上升,以临界值为 A ◻界,不断起动 A 过程和 B 过程。在这个例子中,原因和结果的交互作用,得到了生动的、具体的体现。
因果关系或因果性,是客观存在的关系和规律性,在化学过程中也是普遍存在的。在一定意义上可以说,化学家对化学过程的研究,其主要目的之一就在于揭示客观的化学因果关系,因果制约性。这在化学理论研究中就表现为因果解释。
