历史的回顾
在 1772 年普列斯特里用 8mol/LHNO3 和金属铜作用首次制得无色气体 NO:
8HNO3+3Cu→3Cu(NO3)2+2NO+4H2O
暴露于空气中即转变为 NO2,此后人们用还原剂还原硝酸、硝酸盆及亚硝酸盐溶液都制得了 NO。
商业上,用氨催化氧化法,使氮转化为 NO.NO 转化为 NO2,溶于水
制得硝酸成力制取硝酸的重要方法:
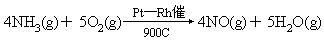
2NO(g)+5O2(g)→2NO2(g)
3NO2(g)+H2O(1)→2HNO3(aq)+NO(g)
 1903
年,采用伯克莱特—艾迪反应(Birke-land-Eyde)。由空气中N2 和 O2
通过放电反应制得 NO:
1903
年,采用伯克莱特—艾迪反应(Birke-land-Eyde)。由空气中N2 和 O2
通过放电反应制得 NO:
然后再转化为硝酸。由于该法产量低,耗费大,故一般不采用这种制法。理已证实,当闪电时,空气中的 N2 和 O2 合成 NO,特化为 HNO3,
随雨水降至地面为植物所利用,是土壤氮的重要来源,亦是自然界固氮的一种方法。NO 可用于制硝酸、肥料及炸药,为高新技木、工农业生产立下了汗马功芳。
