配合性能
在 3.2 节中曾提到 Ag+ 、Cu2+ 、Fe3+ 等金属离子能形成配离子,如[Ag(NH3)2]+、[Cu(NH3)4]2+、[Fe(CN)6]3-等。含有配离子的化合物是配位化合物 ,简称配合物(或称为络合物) ,如[Ag(NH3)2]Cl、[Cu(NH3)4]SO4 、K3[Fe(CN)6]等。铂、金溶解于王水中生成的 H2[PtCl6]和 H[AuCl4]也是配合物。几乎所有的金属元素都能形成配合物。
- 配合物的组成
- 简单配合物 以[Cu(NH3)4]SO4 和 H2[PtCl6]为例,金属离子 Cu2+、Pt4+ 为中心离子,通常也称为配离子的形成体。在它的周围直接配位着一些中性分子或负离子,叫做配位体,简称配体,如 NH3、Cl-。
[Cu(NH3)4]2+SO 2− H + [Pt Cl ]2-
中心离子 配位体 中心离子 配位体
能提供配位体的物质称为配合剂。在配位体中,与中心离子直接相结合的原子叫做配位原子,如上述 NH3 中的 N 原子和 Cl 原子。配位原子必须具有孤对电子,可以提供与中心离子共用,称为配位键,简称配键。与中心离子 直接相结合的配位原子的总数叫做配位数,最常见的配位数是 2,4 和 6。
- 特殊配合物 在上面所述的配合物中,每一个配位体只含有一个配位原子,而在另外一类配位体中,每一个配位体可以含有不只一个配位原子。每一个配位体只能提供一个配位原子的配位体称为单齿配体,而含有两个或两个以上配位原子的配位体称为多齿配体。能提供多齿配体的物质称为螯合剂。例如乙二胺(ethylenediamine,简写为 en)H2NCH2CH2NH2 中含有 2 个配位原子(N 原子)。乙二胺能与中心离子如 Cu2+以环状结构键合而形成稳定的配离子,可表示(以符号“→”表示配位键)如下:
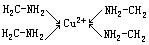
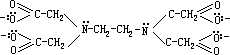 乙二胺四乙酸(ethylenediaminetetraaceticacid,简写为
edta)是一种六齿配体,它能与许多金属离子形成十分稳定的配离子。在乙二胺四乙酸根离子中,4
个羧基上的氧原子(标有孤对电子的)和 2 个氨基上的氮原子都是配位原子:
乙二胺四乙酸(ethylenediaminetetraaceticacid,简写为
edta)是一种六齿配体,它能与许多金属离子形成十分稳定的配离子。在乙二胺四乙酸根离子中,4
个羧基上的氧原子(标有孤对电子的)和 2 个氨基上的氮原子都是配位原子:
这类由多齿配体形成的环状结构配离子称为螯合离子,含有螯合离子的配合物称为螯合物(或称为内配合物)。螯合离子一般相当稳定。例如,如果往[Cu(NH3)4]2+溶液中加入乙二胺,则会发生下列反应:
 [Cu(NH3)4]2++2en
[Cu(en)2]2++4NH3
[Cu(NH3)4]2++2en
[Cu(en)2]2++4NH3
这是由于配离子[Cu(en)2]2+较[Cu(NH3)4]2+更为稳定,使 en 取代NH3 而与Cu2+ 配合。
如果配位化合物的形成体是中性原子,配位体是 CO 分子,这类配合物称
为羰含物。第Ⅴ副族到第Ⅷ族等金属能与 CO 直接作用而生成羰合物。例如, 在 43℃、p(CO2)为 101.325kPa 时,CO 能与镍直接作用生成挥发性的、极毒的羰合物 Ni(CO)4 液体:
 Ni+4CO
Ni(CO)4
Ni+4CO
Ni(CO)4
若把 Ni(CO)4 加热到 50℃,它就会分解成为 Ni 和 CO。利用这类反应可以提取高纯度的金属。
- 价键理论 从微观方面看,配合物与一般化合物的区别在于它们组成
元素的原子间的结合方式--化学键不同。价键理论认为配合物的中心离子(或原子)与配位体间的化学键是配位键。这一理论的基本要点如下:
- 中心离子(或原子)有空的价电子轨道可接受由配位体的配位原子提供的孤对电子而形成配位键。
一般配合物的中心离子(或原子)如下:
| V Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|---|---|---|---|---|---|---|
| Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
它们都是位于 d 区及 ds 区的副族元素;其中最常见的是第Ⅷ族及第Ⅰ、第Ⅱ 副族元素的离子,如 Fe3+、Fe2+、Cu2+、Ag+、Au3+、Zn2+、Hg2+等。中心离子(或原子)的价电子轨道通常指(n-1)d、ns、np 轨道,有时也包括 nd 轨道。配位体的配位原子必须有孤对电子可提供。常见的无机配位体有:
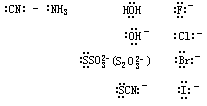
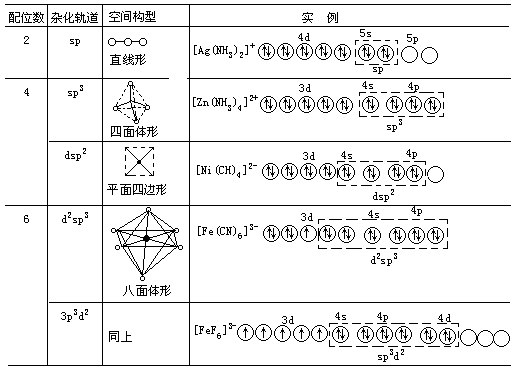
- 在形成配位化合物时,中心离子所提供的空轨道进行杂化,形成各种类型的杂化轨道,从而使配合物具有一定的空间构型。例如,[Ag(NH3)2]+就是以 sp 杂化轨道形成直线形的空间构型。
Ag+的价电子轨道中电子分布为
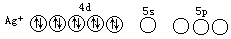
其中 4d 轨道已全充满,而 5s 和 5p 轨道是空的。每一个空轨道可接受 NH3 提供的 1 对孤对电子,共可接受 4 对孤对电子,形成配位数最高为 4 的配合物。但 Ag+的配合物的配位数通常为 2。这说明了中心离子和配位体的性质(如离子电荷、离子半径等)也影响配位数的多少。在[Ag(NH3)2]+中,Ag+采用 sp 杂化轨道与 NH3 形成配位键,空间构型为直线形。
[Ag(NH3)2]+在中心离子 Ag+的价电子轨道中的电子分布为
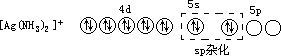
虚线内表示配位体 NH3 分子中 N 原子所提供的孤对电子。
其他配离子或配合物,由于中心离子的空的价电子轨道可包括(n-1)d、ns、np 或 nd 轨道,杂化轨道类型与配合物的空间构型要复杂些(见表 6.2)
- 配位化合物的命名
配位化合物的命名方法服从一般无机化合物的命名原则①。
若与配阳离子(即配离子是正离子)结合的负离子是简单酸根如 Cl-、S2- 或 OH-离子,则该配合物叫做“某化某”;若与配阳离子结合的负离子是复杂酸根如 SO 2− 、Ac-等,则叫做“某酸某”;若配合物含有配阴离子(即配离子是负离子),则在配阴离子后加“酸”字,也叫做“某酸某”,即把配阴离子也看成是一个复杂酸根离子。
配位化合物命名方法较一般无机化合物复杂的问题是配离子的命名。配离子命名时,配位体名称列在中心离子(或中心原子)之前,用“合”字将二者联在一起。在每种配位体前用二、三、四等数字表示配位体的数目(配位体仅一个的“一”字常被省略),对于较复杂的配位体,则将配位体均写在括号中,以避免混淆。在中心离子之后用带括号的罗马数字(Ⅰ)、(Ⅱ)等表示中心离子的氧化值。例如:
[Ag(NH3)2]Cl 氯 化 二 氨 合 银 (Ⅰ) [Cu(en)2]SO4 硫酸二(乙二胺)合铜(Ⅱ) H[AuCl4] 四氯合金(Ⅲ)酸K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾
若某种配合物中配位体不止一种时,不同配位体名称之间以中圆点“·” 分开。配位体列出的顺序按如下规定(摘要):①在配合物中若既有无机配位体又有有机配位体时,则无机配位体排在前,有机配位体排在后;②在同是无机配位体或同是有机配位体中,先负离子而后中性分子;③同类配位体的名称,按配位原子元素符号的英文字母顺序排列。例如:
① 配位化合物的确切定义是由可以给出孤对电子(或多个不定域电子)的离子或分子(称为配体)和接受孤对电子(或多个不定域的空位)的原子或离子(统称为中心原子)所形成的化合物。其命名原则见参考文献[27]。
K[PtCl3(C2H4)] 三氯·(乙烯)合铂(Ⅱ)酸钾[CoCl(NH3)3(H2O)2]Cl2 二氯化氯·三氨·二水合钴(Ⅲ) Co2(CO)8 八羰合二钴
- 配位化合物的应用
配位化合物的应用很广,除利用配合反应可使某些物质溶解(见 3.3 节和6.2.1)外,现再简单介绍两点如下:
- 离子的定性鉴定 许多副族元素的水合离子显有颜色,这是由于这些元素离子与水分子形成配离子而呈现的颜色,如[Cu(H2O)4]2+配离子呈浅蓝色,[Co(H2O)6]3+配离子呈粉红色。如果副族元素离子具有未成对的 d 电子, 由它们作为中心离子而形成的配离子往往显有颜色。例如,[Cu(NH3)4]2+离子呈深蓝色,[Co(NO2)6]3-配离子呈黄色,[Co(NH3)6]3+配离子呈橙色。如果副族元素离子不存在未成对的 d 电子,由它们所形成的配离子就是无色的,如[Ag(NH3)2]+。
一些金属离子与配合剂形成配位化合物时会引起颜色的改变,这可用来鉴定溶液中某种金属离子。例如,氨水能与溶液中的 Cu2+反应生成深蓝色的[Cu(NH3)4]2+。当往待鉴定溶液中加入氨水时,若出现[Cu(NH3)4]2+所具有的深蓝色,则表示原溶液中含有 Cu2+。
 Cu2++4NH3
[Cu(NH3)4]2+
Cu2++4NH3
[Cu(NH3)4]2+
为验证无水酒精是否含有水,可往酒精中投入白色的无水硫酸铜固体, 若变成浅蓝色(水合铜离子的颜色),则表明酒精中含有水。
 溶液中的
Fe3+能与 SCN-形成血红色的物质,主要是[Fe(SCN)]2+配离子: Fe3++SCN-
[Fe(SCN)]2+
溶液中的
Fe3+能与 SCN-形成血红色的物质,主要是[Fe(SCN)]2+配离子: Fe3++SCN-
[Fe(SCN)]2+
该反应对鉴定溶液中的 Fe3+相当灵敏。
也可以用形成有色的难溶配合物来鉴定某些离子。例如,Fe3+ 能与[Fe(CN)6]4- 反应生成深蓝色沉淀 Fe4[Fe(CN)6]3(俗称普鲁士蓝) ,因而K4[Fe(CN)6]可用作鉴定 Fe3+的试剂。
 4Fe3++3[Fe(CN)6]4-Fe
[Fe4(CN)6]3(s)
4Fe3++3[Fe(CN)6]4-Fe
[Fe4(CN)6]3(s)
许多螯合物带有颜色。例如,丁二肟在弱碱性条件下能与 Ni2+形成鲜红色的、难溶于水而易溶于乙醚等有机溶剂的螯合物。这是鉴定溶液中是否有Ni2+存在的灵敏反应。
- 离子浓度的改变和控制 在电镀工艺(见 4.3 节)中,要求在镀件上析出的镀层厚度均匀、光滑细致、与底层金属的附着力强。这常用含有配合剂的电镀液来实现。金属离子与配合剂形成配离子后,就金属离子(原来的简单离子)来说,浓度是显著降低了,但就可能利用的金属离子(简单离子或配离子中的中心离子)来说,则总的浓度并没有改变,即仍可保证原来金属离子总数的供应。配离子的存在起了控制金属离子浓度的作用。例如,在电镀铜工艺中,一般不直接用 CuSO4 溶液作电镀液,而常加入配合剂焦磷酸钾(K4P2O7),使形成[Cu(P2O7)2]6-配离子。溶液中存在下列平衡:
 [Cu(P2O7)2]6-
Cu2++2P2O 4−
[Cu(P2O7)2]6-
Cu2++2P2O 4−
Cu2+的浓度降低,在镀件(阴极)上 Cu 的析出电势代数值减小,同时析出速率也可得到控制,从而有利于得到较均匀、较光滑、附着力较好的镀层。
配离子的形成可显著降低有关金属离子的浓度,这为人体重金属中毒提供了一种有效的解毒方法。例如,edta(或其离子)是一种有强螯合能力的配合剂,不仅能与副族金属离子配合,而且还能与 s、p 区的一些金属离子配合。若人体中有铅中毒,可肌肉注射含 edta 离子的溶液,使 Pb2+以配离子形式进入溶液而从人体中排出。edta 离子也可用于从人体中去除金属元素的放射性同位素,尤其是钚(Pu)。
