表 5.1 氢原子轨道与三个量子数的关系
|
n |
l |
m |
轨道名称 |
轨道数 |
|
|---|---|---|---|---|---|
|
1 |
0 |
0 |
1s |
1 4 1 39 5 1 3 516 7 |
|
|
2 |
0 |
0 |
2s |
||
|
2 |
1 |
0 ,± 1 |
2p |
||
|
3 |
0 |
0 |
3s |
||
|
3 |
1 |
0 ,± 1 |
3p |
||
|
3 |
2 |
0 ,± 1 ,± 2 |
3d |
||
|
4 |
0 |
0 |
4s |
||
|
4 |
1 |
0 ,± 1 |
4p |
||
|
4 |
2 |
0 ,± 1 ,± 2 |
4d |
||
|
4 |
3 |
0 ,± 1 ,± 2 ,± 3 |
4f |
子光谱线的精细结构中提出来的)。虽然从量子力学的观点来看,电子并不存
① 简单地说薛定谔方程是一个如下的二阶偏微分方程: 式中ψ为电子的波函数,m 为电子的质量,E 为电子的总能量,V 为电子的势能。对氢原子来说,电子的势能为 ,e 为电子的电荷,r 为电子与核之间的距离。某些求解的结果可见表 5.2。
在像地球那样绕自身轴而旋转的经典的自旋概念,m
有两个值 1 , 1 , 通
s + 2 − 2
常可用向上和向下的箭头(“↑”“↓”)来表示电子的两种所谓自旋状态。两个电子处于不同的所谓自旋状态叫做自旋反平行,可用符号“↑↓”或“↓
↑”表示;处于相同的所谓自旋状态叫做自旋平行,可以用符号“↑↑”或“↓↓”表示。
综上所述,电子在核外运动可以用四个量子数来确定。2.波函数(原子轨道)的角度分布图
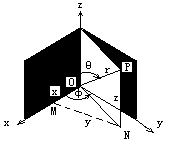
对空间一点的位置,除可用直角坐标 x、y、z 来描述外,还可用球坐标r、θ、φ来表示。代表原子中电子运动状态的波函数以球坐标(r,θφ)表示更为合理,同时也便于薛定谔方程的求解。
从图 5.2,可得直角坐标和球标的转换关系如下:
x=rsinθ cosφy=rsinθ sinφz=rcosθ
经坐标系变换后以直角坐标描述的波函数ψ(x,y,z)转化为以球坐标描述的波函数ψ(r,θ,φ)(见表 5.2)。在数学上又可将氢原子的ψ(r,θ, φ)分解成两部分:
ψ(r,θ,φ)=R(r)·Y(θ,φ)(5.5)
式中,R(r)表示波函数的径向部分,它是变量 r 即电子离核距离的函数;Y (θ,φ)表示波函数的角度部分,它是两个角度变量θ和φ的函数。
