表 5.7 一些物质的分子的电偶极矩和分子的空间构型
|
分 子 |
电偶极矩/ (10-30 · C · m) |
空间构型 |
|
|---|---|---|---|
| 双原子分子 |
HF |
6.07 |
直线形 |
|
HCl |
3.60 |
直线形 |
|
|
HBr |
2.74 |
直线形 |
|
|
HI |
1.47 |
直线形 |
|
|
CO |
0.37 |
直线形 |
|
|
N2 |
0 |
直线形 |
|
|
H2 |
0 |
直线形 |
|
| 三原子分子 |
HCN |
9.94 |
直线形 |
|
H2O |
6.17 |
V 字形 |
|
|
SO2 |
5.44 |
V 字形 |
|
|
H2S |
3.24 |
V 字形 |
|
|
CS2 |
0 |
直线形 |
|
|
CO2 |
0 |
直线形 |
|
| 四原子分子 |
NH3 |
4.90 |
三角锥形 |
|
BF3 |
0 |
平面三角形 |
|
| 五原子分子 |
CHCl3 |
3.37 |
四面体形 |
|
CH4 |
0 |
正四面体形 |
|
|
CCl4 |
0 |
正四面体形 |
注:摘自参考文献[3]第 9-6 ~ 7 页
数值越大表示分子的极性也越大,μ值为零的分子即为非极性分子。对双原子分子来说,分子的极性和键的极性是一致的。例如,H2、N2 等分子是由非极性共价键组成,整个分子的正、负电荷中心是重合的μ值为零,所以是非极性分子。又如,卤化氢分子是由极性共价键组成,整个分子的正、负电荷
中心是不重合的μ值不为零,所以是极性分子。在卤化氢分子中从 HF 到 HI, 由于氢与卤素之间的电负性相差值依次减小,共价键的极性也逐渐减弱,而从表 5.7 中μ的数值来看,分子的极性也是逐渐减弱的。在多原子分子中分子的极性和键的极性往往不一致。例如,H2O 分子和 CH4 分子中的键(O-H 和C-H 键)都为极性键,但从μ的数值来看,H2O 分子是极性分子,CH4 是非极性分子。这与分子的空间构型有关(将在下面介绍)。
- 分子的空间构型和杂化轨道理论
共价型分子中各原子在空间排列构成的几何形状叫做分子的空间构型。例如,甲烷分子为正四面体形,水分子为“V”字形,氨分子为三角锥形等(见表 5.7)。为了从理论上予以说明,鲍林等人以价键理论为基础,提出杂化轨道理论。成功地解释了多原子分子的空间构型和价键理论所不能说明的一些共价分子的形成(如 CH4 等)。现按周期系族数递增的次序,举例说明一些典型分子的空间构型与杂化轨道的关系。
- HgCl2 分子 它的中心原子是第Ⅱ副族的汞,其最外层电子分布式为
6s2,并不包含未成对电子。但实验事实表明 1 个汞原子与 2 个氯原子以 2 个完全相同的共价键结合成直线形的 HgCl2 分子,在水中很难解离。根据价键理论,不具有未成对电子的汞原子不可能与 2 个氯原子形成共价键,因此对于上述 HgCl2 分子的结构,用价键理论是难以说明的。
杂化轨道理论认为,在 HgCl2 分子中汞原子参与成键的轨道已不是原来的 6s 轨道和 6p 轨道,而在成键过程中,已“混合”起来,重新组成 2 个成一直线的新的轨道[见图 5.18(a)]。这种在
图 5.18 sp 杂化轨道角度分布和 sp 杂化过程的示意图
成键时,中心原子中能级相近的轨道打乱“混合”重新组成新轨道的过程叫做轨道杂化,所形成的新轨道叫做杂化轨道。由 1 个 s 轨道与 1 个 p 轨道“混合”组成的杂化轨道称为 sp 杂化轨道[见图 5.18(b)]。每 1 个 sp 杂化轨道
1 1
含有 2 s 成分和 2 p 成分,性质完全相同。在整个杂化和成键过程中,汞原子
的 6s 孤对电子(又称为独对电子)中的 1 个被激发至 6p 轨道,产生 2 个未成对电子。电子的激发、轨道的杂化和成键事实上是同时进行的。
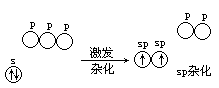
汞原子以 2 个 sp 杂化轨道分别和 2 个氯原子的 3p 轨道重叠,形成直线形 HgCl2 分子。
- BF3 分子 它是平面三角形结构的分子[见图
5.19(a)]中心原子是第Ⅲ主族的硼(B),其外层电子分布式为 2s22p1,在成键过程中,有 1 个 2s 电子激发至 2p 轨道,形成了 3 个未成对电子,同时 B 原子的 1 个 s 轨道与 2 个 p 轨道进行杂化,形成 3 个 sp2 杂化轨道,对称地分布在 B 原子周围,互
2 1 2
成 120°角[见图 5.19(b)]。每 1 个 sp 杂化轨道含有 3 s 成分和 3 p 成分。
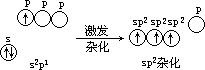
图 5.19 BF2 分子的空间构型和 sp2 杂化轨道角度分布示意图
硼原子以 3 个 sp2 杂化轨道各与 1 个F 原子的 2p 轨道重叠形成平面三角形的BF3 分子。
- CH4 分子 它是正四面体形结构的分子[见图
5.20(a)]。中心原子是第Ⅳ主族的碳(C),其外层电子分布式为 2s22p2。在成键过程中有 1 个 2s 电子激发至 2p 轨道,产生 4 个未成对电子,同时 C 原子的 1 个 2s 轨道与 3 个p 轨道杂化,形成 4 个 sp3 杂化轨道,对称地分布在 C 原子周围,互成 109°
3 1 3
18'[见图 5.20(b)]。每 1 个 sp 杂化轨道含有 4 s 成分和 4 p 成分。碳原子以
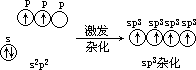 4
个 sp3 杂化轨道各与 1 个氢原子的 1s 轨道重叠形成正四面体形的 CH4 分子。
4
个 sp3 杂化轨道各与 1 个氢原子的 1s 轨道重叠形成正四面体形的 CH4 分子。
图 5.20 CH4 的空间构型和 sp2 杂化轨道角度分布示意图
上述 sp、sp2、sp3 杂化中,中心原子分别为第Ⅱ族(主族或副族)和第Ⅲ、第Ⅳ主族元素,所形成杂化轨道的夹角(分别为 180°,120°,109°28')随杂化轨道包含的 s 成分的减少和 p 成分的增多而减小。同时在同一类杂化中形成的杂化轨道的性质完全相同,所以这类杂化叫做等性杂化。然而,对于第Ⅴ主族和第Ⅵ主族元素,在与其他原子成键时又是如何构成分子的呢?现以 NH3 和 H2O 分子为例进一步说明。
- NH3 分子和 H2O 分子
前者为三角锥形结构的分子,后者为Ⅴ字形结构分子(见图 5.21)。中心原子分别为第Ⅴ主族的氮(N)和第Ⅵ主族的氧(O)。N 原子的外层电子分布式为 2s22p3,有 3 个未成对的 p 电子。若 3 个相互垂直的 p 轨道各与 1 个 H 原子的 1s 轨道重叠,则 NH3 分子中的键角∠HNH 应为90°,但根据实验测定键角为 107°。O 原子外层电子分布式为 2s22p4,有 2 个未成对的 p 电子。若 2 个相互垂直的p 轨道各与 1 个H 原子的 1s 轨道重叠, 则 H2O 分子中的键角∠HOH 也应为
90°,但根据实验测定键角为 104°40'。
图 5.21 NH3 分子和 H2O 分子的空间构型示意图
(阴影处表示孤对电子所占据的杂化轨道)
杂化轨道理论认为 NH3 分子中的 N 原子和 H2O 分子中的 O 原子在成键过程中都形成 4 个 sp3 杂化轨道,如果 4 个杂化轨道是等性的,则键角∠HNH、
∠HOH 也应是 109°28'。NH3 分子中有 1 个 sp3 杂化轨道由未参与成键的孤对
电子所分布。H2O 分子中有 2 个 sp3 杂化轨道分别由孤对电子所分布,这样 4 个杂化轨道所含的成分就不完全一样。在孤对电子所分布的杂化轨道中,杂
1
化轨道的形状更接近于 s 轨道,所以 s 成分相对地要多一些(> 4 ),而成键
1
电子对所分布的杂化轨道中 s 成分相对地要少一些(< 4 ),即相应的 p 成分
3
要多一些(> 4 )。随着 p 成分的增多,杂化轨道间的夹角应减小。若为纯 p
轨道,则成键轨道间的夹角应为 90°。NH3 分子和 H2O 分子中成键电子对所分布的杂化轨道由于 p 成分较多,使其夹角小于 109°28',向 90°方向有所偏近,分别为 107°和 104°40',而 H2O 分子中的 p 成分更多,所以其成键轨道间的夹角比 NH3 分子中的更小。这种由于孤对电子的存在,使各个杂化轨道中所含的成分不同的杂化叫做不等性杂化。NH3 分子和 H2O 分子中的轨道杂化属于 sp3 不等性杂化,CH4 分子中的轨道杂化属于 sp3 等性杂化。因此, 甲烷分子的空间构型完全对称,而氨和水分子的空间构型为不完全对称,从而反映在分子的极性上有着显著的差异,前者为非极性分子,而后两者为极性分子。上述由 s 轨道和 p 轨道所形成的杂化轨道和分子的空间构型可归纳于表 5.8 中。
