表 3.1 不同温度时水和冰的蒸气压力
|
温度℃ |
-20 |
-15 |
-10 |
-6 |
-5 |
-4 |
-3 |
-2 |
-1 |
0 |
|---|---|---|---|---|---|---|---|---|---|---|
|
冰的蒸 气压/Pa |
103 |
165 |
260 |
369 |
402 |
437 |
476 |
518 |
563 |
611 |
|
水的蒸 气压/Pa |
391 |
422 |
455 |
490 |
527 |
568 |
611 |
|||
|
温度/℃ |
5 | 10 |
20 |
30 |
40 |
60 |
80 |
100 |
150 |
200 |
|
水的蒸 气压/Pa |
873 |
1228 |
2339 |
4246 |
7381 |
19932 |
47373 |
101325 |
475720 |
1553600 |
注:摘自参考文献[3]第 6-11 ~ 13 页。
体表面的分子也能蒸发。如果把固体放在密封的容器内,固体(固相)和它的
蒸气(气相)之间也能达成平衡,此时固体具有一定的蒸气压力。固体的蒸气压力也随温度的升高而增大。表 3.1 中也列出了一些在 0℃以下不同温度时冰及水的蒸气压力。
当某一液体的蒸气压力等于外界压力时,液体就会沸腾,此时的温度称为该液体的沸点,以 bp(boilingpoint 的缩写)表示。而某物质的凝固点(或熔点) 是该物质的液相蒸气压力和固相蒸气压力相等时的温度,以fp(freezingpoint 的缩写)表示。若固相蒸气压力大于液相蒸气压力,则固相就要向液相转变,即固体熔化。反之,若固相蒸气压力小于液相蒸气压力, 则液相就要向固相转变。总之,若固液两相的蒸气压力不等,两相就不能共存,必有一相要向另一相转化。
一切可形成晶体的纯物质,在给定条件下,都有一定的凝固点和沸点。但溶液的情况并非如此,一般由于溶质的加入会使溶剂的凝固点下降、溶液的沸点上升。而且溶液越浓,凝固点和沸点改变越大。
这些现象是由于溶液中溶剂的蒸气压力下降所引起的。现在通过水溶液的例子来说明这个问题。
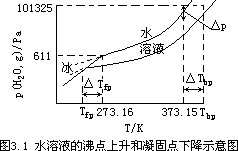
以蒸气压力为纵坐标,温度为横坐标,画出水和冰的蒸气压力曲线,如图 3.1 所示。水在正常沸点(100℃即 373.15K)时其蒸气压力恰好等于外界压力(101.325kPa)。如果水中溶解了难挥发性的溶质,其蒸气压力就要下降。因此,溶液中溶剂的蒸气压力曲线就低于纯水的蒸气压力曲线,在 373.15K 时溶液的蒸气压力就低于 101.325kPa。要使溶液的蒸气压力与外界压力相等,以达到其沸点,就必须把溶液的温度升到 373.15K 以上。从图 3.1 可见, 溶液的沸点比水的沸点高△Tbp(沸点上升度数)。
从图 3.1 还可以看到,在 273.16K 时①,冰的蒸气压力曲线和水的蒸气压力曲线相交于一点,即此时冰的蒸气压力和水的蒸气压力相等,均为 611Pa。由于溶质的加入使所形成的溶液的溶剂蒸气压力下降。这里必须注意到,溶质是溶于水中而不溶于冰中,因此只影响水(液相)的蒸气压力,对冰(固相) 的蒸气压力则没有影响。这样在 273.16K 时、溶液的蒸气压力必定低于冰的蒸气压力,冰与溶液不能共存,冰要转化为水,所以溶液在 273.16K 时不能结冰。如果此时溶液中放入冰,冰就会融化,在融化过程中要从系统中吸收热量,因此系统的温度就会降低。在 273.16K 以下某一温度时,冰的蒸气压力曲线与溶液的溶剂蒸气压力曲线可以相交于一点,这温度就是溶液的凝固点。它比纯水的凝固点要低△Ttp(凝固点下降度数)。
① 这里说的是纯液体水与冰和水蒸气组成的系统。如果液体水和冰置于大气环境下,液体水溶有空气并达到饱和,此时水的凝固点为 273.15K。在初级课程中,常常忽略这种差别,并作为大气压力下的情况来讨论。
溶液的溶剂蒸气压力下降度与溶液的浓度有关,而溶剂的蒸气压力下降又是溶液沸点上升和凝固点下降的根本原因。因此,溶液的沸点上升和凝固点下降也必然与溶液的浓度有关。
难挥发① 的非电解质稀溶液的沸点上升和凝固点下降与溶液的质量摩尔浓度(所谓质量摩尔浓度 m 是指在 1kg 溶剂中所含溶质的物质的量)成正比, 可用下列数学式表示:
△Tbp=kbpm (3.2)
△Tfp=kfpm (3.3)
式中,kbp 与 kfp 分别称做溶剂的摩尔沸点上升常数和溶剂的摩尔凝固点下降常数(单位为 K·kg·mol-1)。表 3.2 中列出了几种溶剂的沸点、凝固点、kbp 和 kfp 的数值。
