一、酸的电离
酸类有相似的化学性质,有人猜想,这是不是与酸类有相似的组成有关? 为了证明这一点,我们来做一个酸类水溶液的导电性实验。
[实验 3—11]装置如图 3—6 所示。将蒸馏水、稀盐酸、稀硫酸和稀硝酸分别加入四个广口瓶中,依次插入电极,接通电源,观察灯泡是否发亮?(注意,每次试验后应将电极冲洗干净)。
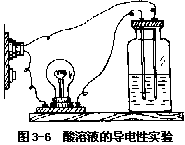
·试验蒸馏水,灯泡 。
·试验稀盐酸、稀硫酸和稀硝酸,灯泡 。
实验中灯泡发亮,说明有电流通过,即被试物质导电。上述实验证明, 蒸馏水不导电,稀盐酸、稀硫酸和稀硝酸导电。如果用其它的酸的水溶液做实验,结果相同。
如何解释稀酸类水溶液能导电呢?
我们知道,金属导电是由于金属中有自由移动的电子,这些电子在电场作用下发生定向移动,形成了电流。酸类水溶液能够导电,必然也是存在着能够自由移动的带电的微粒。科学研究证明,这种带电微粒不是电子,而是离子。离子是怎样产生的?那是由于在水溶液中酸的分子在水分子的作用下发生离解,生成了能自由移动的带正电荷的氢离子和带负电荷的酸根离子。这个过程可以表示如下:
HCl=H++Cl-
+ 2-
H 2SO4 =2H + SO
HNO3=H++NO3-
当通电时,这些带有正负电荷的离子在电场的作用下发生定向运动,产生电流。这就是酸类水溶液导电的原因。
酸在水溶液中,离解成能自由移动的氢离子和酸根离子的过程,叫做**酸 的电离。**上述表示物质电离的方程式,叫做电离方程式。
从上述酸的电离方程式可以看出,它们都电离出共同的阳离子——氢离子。因此,它们有相似的化学性质。
问题 酸既然能电离出带正电荷的氢离子和带负电荷的酸根离子,为什么酸并不带电?
