二、硫酸
- 稀硫酸
稀硫酸与盐酸的性质相似。
下面是一组有关稀硫酸化学性质的实验,注意观察并做好记录。[实验 3—5]按图 3—4 做实验,试管(5)稍加热,观察并记录。
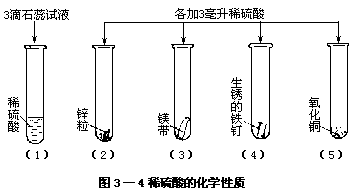
·试管(1)溶液变成 。
·试管(2)、(3)发生反应。点火证明放出了 气。试管(3)比(2)反应 。
·试管(4)铁锈 ,溶液呈 色。
·试管(5)氧化铜 ,溶液呈 色。
上述实验表明:
-
稀硫酸可使石蕊试液变红。
-
稀硫酸跟某些金属发生反应,产生氢气。
Zn+H2SO4=ZnSO4+H2↑ Mg+H2SO4=MgSO4+H2↑
- 稀硫酸跟金属氧化物发生反应。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
硫酸铁(溶液棕黄色)
CuO+H2SO4=CuSO4+H2O
硫酸铜(溶液蓝色)
- 浓硫酸
[实验 3—6]观察纯净的浓硫酸和工业浓硫酸的颜色、状态,小心拿一下盛装浓硫酸的试剂瓶,体验它跟同样一瓶水质量的差异。
纯净的浓硫酸是没有颜色、粘稠、油状的液体,不挥发。常用浓硫酸的浓度是 98%,密度是 1.84 克/厘米 3,比水几乎重一倍。工业浓硫酸因含杂质,通常呈灰黑色。
浓硫酸有不同于稀硫酸的特殊性质。(1)吸水性
有人做过一个实验,将浓硫酸盛放在一个烧杯中,称量了它们的质量。过几天以后,再称量它们的质量,发现质量增加了。这是什么原因?这是由于浓硫酸有吸水性,吸取空气中的水蒸气,从而增加了质量。
由于浓硫酸有吸水性,所以它可以用作某些气体的干燥剂。(2)脱水性
[实验 3—7]用玻璃棒蘸浓硫酸,在白纸上写化学式“H2SO4”。过一会儿, 观察纸上有什么变化。用火柴梗蘸一点儿浓硫酸,放置一会儿,观察火柴梗有什么变化。
·纸上出现 色 字样。
·火柴梗变 。
用浓硫酸在纸上写字,字迹变黑;用火柴梗蘸浓硫酸,火柴梗也变黑。这是由于纸张、木柴均是由碳、氢、氧等元素组成的,浓硫酸与这些物质接触,能将它们中的氢、氧元素按水的组成比(两个氢原子跟一个氧原子结合) 夺去,留下黑色的碳,也就是使它们“碳化”。浓硫酸的这种性质,叫做脱水性。浓硫酸还有腐蚀性,它强烈腐蚀衣服、皮肤。如果衣服或皮肤上不慎沾上浓硫酸,应立即用布拭去,再用水冲洗。
浓硫酸易溶于水,溶解时放出大量的热。
[实验 3—8]把浓硫酸沿盛水的烧杯壁缓缓倒下,不断搅拌,用手摸烧杯外壁,试试溶液温度的变化。
浓硫酸溶于水放出大量的热。如果把水倒入浓硫酸里,水的密度比浓硫酸小,浮在上面,它与浓硫酸接触放出大量的热,这些热使水沸腾,造成浓硫酸四处飞溅。为了防止事故,在稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速散失。切不可把水倒进浓硫酸里。
浓硫酸跟金属反应不放出氢气。
硫酸是一种非常重要的化工原料,广泛应用于生产化肥(过磷酸钙、硫酸铵)、农药、炸药、染料以及冶炼有色金属、精炼石油、金属去锈等方面。
