一、盐酸
盐酸是氯化氢的水溶液,浓盐酸含氯化氢 36%~38%。1.盐酸的物理性质
〔实验 3—1〕观察纯净的浓盐酸和工业盐酸的颜色、状态。打开瓶塞, 闻一闻它的气味,并观察瓶口发生的现象,做好记录。
|
颜色 |
气味 |
瓶口发生的现象 |
|
|---|---|---|---|
|
纯浓盐酸 工业盐酸 |
纯净的盐酸是无色、透明的液体,工业盐酸因含杂质而带黄色。浓盐酸有刺激性气味。打开瓶塞产生的白雾,是挥发出来的氯化氢遇到空气中的水蒸气,形成盐酸小液滴聚集而成的。盐酸有酸味,能损坏衣物,灼伤皮肤, 蒸气对眼睛有伤害。
2.盐酸的化学性质(1)使石蕊试液变色
[实验 3—2]照图 3—1 做实验,观察并记录。3 滴石蕊试液
·石蕊试液呈 色。
·反应后溶液变成 色。

实验结果跟石蕊试液与碳酸作用一样,石蕊试液原呈紫色,反应后生成的溶液变成红色。像石蕊这样能跟某些物质溶液起作用而显示特征颜色的物质,叫做指示剂。
- 跟某些金属反应,放出氢气
在第一册第六章中已经学习过,锌跟盐酸或稀硫酸分别反应能制得氢气,同时生成氯化锌或硫酸锌。现在让我们试验镁、铁跟盐酸的反应。
[实验 3—3]照图 3—2 做实验,观察并记录。
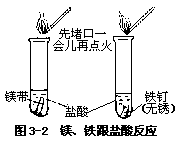
·镁与盐酸反应 ,放出的气体点火 。溶液呈 色。·铁
与盐酸反应激烈程度比前者稍 ,放出的气体点火 。溶液呈 色。
盐酸与镁、铁发生置换反应,分别生成氢气、氯化镁和氯化亚铁。Mg+2HCl=MgCl2+H2↑ Fe+2HCl=FeCl2+H2↑
氯化亚铁
- 跟金属氧化物反应,生成氯化物和水
[实验 3—4]照图 3—3 做实验,观察并记录。
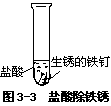
·铁钉的锈呈 色。
·铁钉上的锈在盐酸中被 。
·溶液呈 色。
铁锈的主要成分是铁的氧化物和氢氧化物(氧化物的主要成分是Fe2O3),呈暗红色。生锈的铁钉在盐酸中浸泡,铁锈就与盐酸起反应,生成可溶性的氯化铁,溶液呈黄色。工业盐酸呈黄色就是由于含有杂质氯化铁。
Fe2O3+6HCl=2FeCl3+3H2O
氯化铁
盐酸是重要的化工产品,大量用来给金属除锈,制造氯化物、药物,食品工业上用于制造化学酱油、味精、葡萄糖等。人的胃里含有少量的盐酸, 可以帮助消化,抑制和杀死细菌。
