1. 电离酸、碱、盐的初步概念化合物水溶液的导电性
============================================
【观察与思考】
图 6-5 表示的是能同时试验几种物质导电性的装置,其中主要包括低压电源、石墨电极、显示电路里有无电流通过的电灯泡,以及盛有待试验物质的容器(4 组容器,每组 3 只)四部分。在 12 只容器里依次加入:
干燥的食盐晶体、硝酸钾晶体、氢氧化钠晶体、蔗糖晶体、酒精、蒸馏水、食盐溶液、硝酸钾溶液、氢氧化钠溶液、磷酸溶液、蔗糖溶液、酒精溶液。
将石墨电极分别插入待试验物质中,连接低压电源,观察灯泡是不是发光。
从上面的实验可以看到,干燥的食盐晶体、硝酸钾晶体、氢氧化钠晶体、蔗糖晶体、酒精都不导电,蒸馏水也不导电①,可是,食盐、硝酸钾、氢氧化钠、磷酸的水溶液却能够导电,蔗糖和酒精的水溶液不能导电。
【观察与思考】取几克硝酸钾晶体(或其它易熔的盐,如氯化锌等)加入瓷坩埚内,放在铁架台上,加热到硝酸钾晶体熔化,插入电极,连接低压电源,观察灯泡是不是发光。
从上面的实验可以看到,熔化的硝酸钾能够导电。
电离方程式 我们知道,电流是由带电微粒按一定方向移动而形成的。金属能够导电,就是由于金属中存在能自由移动的、带负电的电子。为什么食盐、硝酸钾、氢氧化钠等物质在干燥时不导电,而溶于水或熔化时却能导电呢?说明这些物质的水溶液或熔化而成的液体里,存在着能自由移动的、带电的微粒。
我们已经知道食盐是离子化合物,在食盐的晶体里含有带正电的钠离子
(Na+)和带负电的氯离子(Cl-),由于静电的作用,它们按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的食盐不能导电。
当食盐在水里溶解时,由于水分子的作用减弱了钠离子和氯离子之间的吸引力,使食盐晶体离解成能自由移动的带电的钠离子和氯离子(图 6-6), 因而食盐溶液能够导电。
食盐晶体受热熔化时,由于离子的运动随温度升高而加快,克服了带不同电荷的离子间的引力,产生了能自由移动的钠离子和氯离子,因而食盐在熔化状态也能导电。
硝酸钾、氢氧化钠等离子化合物在溶于水或熔化时,也产生能够自由移动的离子,因此也能够导电。
化合物溶于水或受热熔化时,离解成自由移动的离子的过程,叫做电离。某些共价化合物如氯化氢、硫酸等,虽然熔化(即液态)时基本不电离,
但溶于水时却能电离。所以这些化合物液态时基本不导电,而其水溶液却能导电。
化合物的电离可用电离方程式来表示: NaCl====Na++Cl-
NaOH====Na++OH-
① 严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
KNO3====K++NO3-
【选学】 氯化氢在水里的溶解和电离
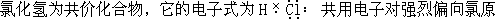
子一方,但不是离子。当氯化氢溶于水时,在水分子及其运动的作用下,如图 6—7 所示,迅速电离成为在溶液中自由移动的氢离子和氯离子(严格地说是水合氢离子和水合氯离子)。
溶液里或熔化的化合物里,电离生成的阳离子所带的正电荷总数和阴离子所带的负电荷总数是相等的,所以整个溶液或熔化的化合物不显电性。
