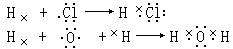离子化合物和共价化合物
上一节我们学习了原子核外电子排布的初步知识,在此基础上,本节将着重学习不同元素的原子是怎样形成化合物的。
离子化合物
【观察与思考】
装置见图 6-2,在集满氯气的瓶口上放一小块铁丝网(最好是不锈钢丝网),取一小块钠,用滤纸吸干煤油后用坩埚钳夹住,在铁丝网上来回摩擦, 使钠的碎屑落入集气瓶里。注意观察,钠屑一遇到氯气就发生燃烧,并生成白色固体氯化钠。在这个实验中,钠和氯的原子发生了怎样的变化呢?

个电子。在化学反应中,钠原子容易失去最外层 1 个电子,使次外层变成最外层。

应中,氯原子容易得到 1 个电子,使最外层达到 8 个电子。
当氯跟钠反应时,气态钠原子最外层的 1 个电子转移到气态氯原子的最
外层上去,这样两个原子的最外层都变成 8 个电子的稳定结构。
如图 6-3 所示,在化学反应过程中,钠原子因失去 1 个电子而带上了 1
个单位的正电荷;氯原子因得到 1 个电子而带上了 1 个单位的负电荷。这种带电的原子或原子团叫做离子。带正电的离子叫做阳离子,如钠离子(Na+);带负电的离子叫做阴离子,如氯离子(Cl-)。这两种带有相反电荷的离子之间有静电引力,同时两个离子的核之间以及它们的电子之间又有斥力。当引力与斥力达到平衡时就形成了化合物氯化钠,它整体上呈电中性。化学反应方程式是:
2Na+Cl2====2NaCl
像氯化钠这种由阴、阳离子相互作用而构成的化合物,叫离子化合物。氧化钙(CaO)、硫酸锌(ZnSO4)、氢氧化钠(NaOH)等都是离子化合物。构成离子化合物的微粒不是分子,而是阴离子和阳离子。
共价化合物
【观察与思考】
装置见图 6-4,点燃纯净氢气,观察发生的现象。再慢慢挤压盛满氯气的塑料袋,让氯气通入玻璃管,再观察发生的现象。
实验结果表明:氢气在氯气中继续燃烧,产生的火焰呈苍白色,生成无色、有刺激性气味的气体,在空气中形成“白雾”。科学实验证明该气体是氯化氢,化学式是 HCl。
氯和氢都是非金属元素,它们的原子是怎样构成氯化氢的呢?
7 个电子,在化学反应中,氯原子有获得一个电子形成最外层 8 个电子稳定
结构的倾向,而氢原子核外只有一个电子层,且只有 1 个电子,它在化学反
应中也有获得 1 个电子、形成最外层 2 个电子稳定结构的倾向。氢原子和氯
原子都不能把对方的电子夺过来。它们相互作用的结果是双方各以最外层 1 个电子组成一个电子对,这个电子对为氢原子和氯原子所共用,并在两个原子核外的空间运动,从而使双方最外层都达到稳定结构。这种电子对叫共用电子对。在氯化氢里共用电子对受氯原子和氢原子两个核的共同吸引,使两个原子形成了氯化氢的分子。在氯化氢分子里,由于氯原子对电子对的吸引力比氢原子稍强,电子对偏向氯原子一方,因此氯原子一方略显负电性,氢原子一方略显正电性,但分子整体仍显电中性。这一反应的化学方程式是: H2+Cl2====2HCl
像氯化氢这样原子间以共用电子对形成的化合物,叫做共价化合物,如水(H2O)、二氧化碳(CO2)等都是共价化合物。
在上述化学反应中,一般是原子的最外层电子发生变化,因此,为了简便起见,我们可以在元素符号周围用小黑点(或×)来表示原子的最外层电子,这种式子叫做电子式。例如:
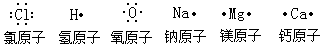
离子化合物氯化钠、氯化镁的形成过程可用电子式表示如下:
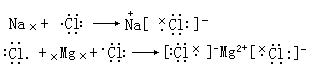
共价化合物氯化氢、水的形成过程,也可用电子式表示如下: