一、盐酸
盐酸是氯化氢的水溶液。我们的胃液里就含有盐酸。吃到胃里的食物在胃液的作用下分解消化,最后为人体所吸收。但胃液里的盐酸与其它物质混和在一起,难辨其“庐山真面目”。那末纯净的盐酸具有什么样的性质呢?
【观察与思考】
取纯净的浓盐酸和工业用浓盐酸各一瓶,观察它们的颜色和状态。打开瓶塞,用手轻轻地在瓶口扇动,小心地嗅盐酸的气味,并观察瓶口附近发生的现象。想一想,为什么(图 9-1)?
纯净的盐酸是一种无色的液体,易挥发,有强烈的刺激性气味,有酸味。工业用盐酸通常带有黄色,那是因为混有杂质的缘故。常用的浓盐酸约含有37%~38%的氯化氢,密度为 1.19 克/厘米 3。若打开盛有浓盐酸的瓶塞, 就会看到瓶口附近形成“白雾”。这是由于从浓盐酸里挥发出来的氯化氢跟空气里的水蒸气接触,重新结合为盐酸小液滴,许多盐酸小液滴散布在空气中,看起来像白雾。盐酸跟指示剂的反应我们已经知道,紫色石蕊试液遇盐酸变红色,无色酚酞试液遇盐酸不变色。盐酸跟金属的反应我们还知道,盐酸能跟金属锌起反应,生成氯化锌和氢气。反应的化学方程式是:
Zn+2HCl===ZnCl2+H2↑
盐酸还可以跟金属活动顺序表中排在氢前面的金属如钾、钙、钠、镁、铝、铁等发生置换反应,生成相应的金属氯化物(属盐类)和氢气。
【实验与思考】
盐酸跟金属氧化物的反应把一根表面生锈的铁钉放入盛有稀盐酸的试管里,过一会儿取出,用水洗净,观察铁钉表面及溶液的颜色有什么变化。铁钉表面的锈没有了,溶液由无色变为黄色。这是由于盐酸跟铁锈(主要成分是 Fe2O3)起反应,生成可溶性氯化铁的缘故。工业盐酸常带黄色,主要就是因为其中含有三氯化铁等的缘故。反应的化学方程式如下:
Fe2O3+6HCl===2FeCl3+3H2O
其它一些金属氧化物如氧化铝、氧化铜等也能跟盐酸起反应生成相应的可溶性金属氯化物和水。
【思考与练习】
完成下列化学方程式: Al2O3+HCl—— CuO+HCl——
以上反应,常用来清除金属表面的金属氧化物。
【实验与思考】盐酸跟碱的反应在盛有少量氢氧化铜固体的两支试管里,分别加入适量的水和盐酸。对照观察发生的变化。实验表明,氢氧化铜是一种蓝色的固体,不溶于水,但能溶于盐酸,实质上就是氢氧化铜和盐酸反应生成溶于水的蓝绿色的氯化铜(属于盐类)和水。反应的化学方程式是:
Cu(OH)2+2HCl===CuCl2+2H2O
盐酸还能跟其它的碱如 NaOH、KOH、Ca(OH)2 等反应生成相应的盐和水。
【问题讨论】
胃酸分泌过多,就会引起胃病,为了缓解这种病痛,医生有时给病人服用一种叫做胃舒平的药物。胃舒平的主要成分是氢氧化铝[Al(OH)3]。你能说出治疗的化学原理吗?盐酸跟盐的反应我们已经学习过盐酸能与碳酸钙
(属于盐类)反应生成氯化钙(属于盐类)和碳酸(属于酸类)。碳酸不稳定,分解成二氧化碳和水。反应的化学方程式如下:
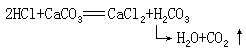
盐酸还能跟其它盐如硝酸银(AgNO3)反应。
【实验与思考】
在盛有少量稀盐酸的试管里滴加几滴硝酸银溶液,观察发生的现象。盐酸跟硝酸银溶液起反应,生成白色凝乳状的氯化银沉淀和稀硝酸(氯化银不溶于水和稀硝酸)反应的化学方程式如下:
HCl+AgNO3====AgCl↓+HNO3
这个反应常用于检验盐酸和其它电离时能产生 Cl- 离子的化合物如NaCl、KCl 等。
【问题讨论】
试推测氯化钠溶液与硝酸银溶液反应的结果。并做一做这个实验,验证一下你的推测是否准确?从盐酸分别与金属氧化物、碱、盐进行反应的形式来看,它们的共同点是参加反应的两种化合物相互交换成分,生成另外两种化合物,如图 9-2 所示。像这类由两种化合物互相交换成分生成另外两种化合物的反应,叫做复分解反应。至此,我们已经学习过了从反应形式上分类的四种基本反应类型,它们分别是化合反应、分解反应、置换反应和复分解反应。
【思考与练习】
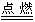 试判别下列反应各属何种基本反应类型。
试判别下列反应各属何种基本反应类型。
 C+O2
CO2 Zn+2HCl====ZnCl2+H2↑
C+O2
CO2 Zn+2HCl====ZnCl2+H2↑
NaOH+HCl====NaCl+H2O
盐酸不仅在人的生理活动中有着十分重要的作用,同时也是一种重要的化工产品。它除了用于金属表面除锈外,还用于制造各种金属氯化物如氯化锌等以及某些试剂和药物,例如盐酸麻黄素等。
