复习与练习 一、整理知识
1.物质的简单分类
金属
单质
非金属
一元酸
酸二元酸
三元酸
无机物
纯净物 可溶性碱
化合物碱不溶性碱
盐
酸性氧化物
碱性氧化物
有机物(略)
上列各类物质相互关系的初步知识。2.复分解反应
由两种化合物互相交换成分生成另外两种化合物的反应,叫做复分解反应。
溶液中复分解反应发生的条件是:有沉淀生成或有气体放出,或有水生成。
3.化学反应的四种基本类型
-
化合反应 A+B+⋯→AB⋯(反应物可以是两种以上)
-
分解反应 AB⋯→A+B+⋯(生成物可以是两种以上)
-
置换反应 A+BC→AC+B
-
复分解反应 AB+CD→AD+CB 4.金属活动性顺序及其应用
在金属活动性顺序中,金属的位置越靠前,它的活动性就越强。
在金属活动性顺序里,排在氢前面的金属能置换出酸里的氢;排在前面的金属一般能够把排在后面的金属从它们的盐溶液里置换出来。
5.溶液酸碱度的表示法——pH 值
溶液的 pH 值等于 7 为中性,pH 值小于 7 为酸性,pH 值大于 7 为碱性。6.化学肥料
多数化肥产品属于盐类,常用的化肥是含氮、磷、钾三种元素的化肥, 此外还有复合肥料和微量元素肥料。化肥只有合理施用才能提高化肥的利用率,降低生产成本,增加效益。
二、练习题1.填空
-
盐酸的 pH 值 7,氢氧化钠溶液的 pH 值 7。把氢氧化钠溶液滴入盐酸中,盐酸的 pH 值 。
-
CO2 通入石灰水中,生成 和
,CO2 是 氧化物。
-
生石灰跟盐酸起反应,生成 和 ,生石灰是 氧化物。
-
在金属活动性顺序中,铝排在铜的 ,因此铝的活动性比铜
,铝能置换酸中的氢而铜则 。
- 按照物质分类,锌属 ,生石灰属 ,五氧化二磷属 ,
烧碱属 ,胆矾属 。
- 将正确答案的序号填在题后的括号里
-
同质量的下列物质与足量盐酸混和,发生反应,产生气体质量最大的是 [ ]
- 锌 B.铜
C.碳酸铁 D.铁
-
在通常条件下,下列物质中,可以用金属跟稀盐酸直接反应制得的是 [ ]
- CuCl2 B.AgCl
C.HgCl2 D.FeCl2
-
有两片质量相等的锌片,使其中一片跟足量的稀硫酸起反应,另一片先煅烧成氧化锌,然后也跟足量的稀硫酸起反应。用两种方法制得的硫酸锌的质量 [ ]
- 第一种方法制得的硫酸锌的质量大B.相等
C.第二种方法制得的硫酸锌的质量大D.无法比较
- 有一种盐酸盐,通过实验分析含氯 47.65%,这种物质是
[ ]
- NaCl B.KCl C.CaCl2 D.MgCl2
- 下列说法中正确的是 [ ] A.在 pH 值为 10
的溶液中,加入无色酚酞溶液后不变色
-
食盐溶液能够导电是由于电流通过溶液时,产生了自由移动的钠离子和氯离子
-
化合物电离产生的阳离子数目和阴离子数目一定相等
-
碱具有通性的原因是由于各种碱在水溶液里能电离出 OH-离子的
缘故
- 完成下列反应的化学方程式,并注明反应类型
(1)Mg+O2——
-
Mg+HCl——
-
MgO+H2SO4——
-
Mg(OH)2+HNO3——
-
Mg+CuCl2——
-
MgSO4+BaCl2——
-
MgCl2+NaOH——
-
写出下面一系列物质变化的化学方程式(1)Cu→CuO→CuSO4→Cu(OH)2→CuSO4→Cu
(2)C→CO2→CaCO3→CaO→Ca(OH)2→CaCl2
-
有 4 瓶无色溶液
A、B、C、D,分别是盐酸、硝酸、氢氧化钠溶液和氢氧化钡溶液:
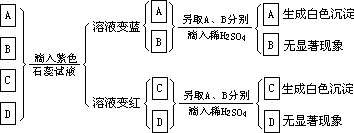
A、B、C、D 分别是什么溶液,写出有关化学方程式。6.用化学方法解决下列问题,并写出有关化学方程式。
-
盐酸中是否含有硫酸?
-
烧碱中是否含有消石灰? 7.计算
-
现有浓度为 98%、密度为 1.84 克/厘米 3 的浓硫酸,要配制 500 克 20%硫酸,需用浓硫酸和水各多少毫升?怎样操作?
-
向 5 克食盐水中滴入硝酸银溶液到不再产生沉淀为止。把得到的AgCl 沉淀充分干燥后称量,质量为 0.1 克。求这种食盐水的百分比浓度。
-
某校办厂用废铁屑跟废硫酸反应来制取硫酸亚铁,现用废硫酸 9.8 吨(含纯硫酸 20%)跟足量的废铁屑反应(杂质不与铁屑反应生成 FeSO4)。问最多可生产 FeSO4·7H2O 多少吨?
