1
2
1. 氧气的性质和用途
================
氧气是空气的主要成分之一,本节将着重讨论氧气的性质和用途。氧气的物理性质
【观察与思考】
展示一瓶氧气,观察它的颜色、状态,并闻一闻它的气味。
在通常情况下,氧气是一种无色、无味的气体,在标准状况下氧气的密度为 1.429 克/升,比空气略重(空气的密度为 1.293 克/升)。氧气在 1.013
×105 帕下,—183℃时液化,液态氧呈蓝色,— 218℃时凝固为淡蓝色的雪花状固体。氧气不易溶于水,1 升水中大约能溶解 30 毫升氧气。氧气在水中虽然溶解得很少,但鱼类等水生动植物的生存,却有赖于溶解于水中的氧气。
氧气的化学性质
为了研究氧气的化学性质,让我们做几个实验,看看它跟哪些物质发生反应,反应需要什么条件,反应时有什么现象,反应后生成什么物质?
【观察与思考】
-
取一小块木炭,放在燃烧匙里,伸进盛有氧气的集气瓶,观察木炭是否燃烧。
-
再把木炭在酒精灯上加热到发红,先观察它在空气中燃烧的情况,然后连同燃烧匙伸进盛有氧气的集气瓶里,观察现象。
-
待燃烧停止后,立即向瓶内倒进一些澄清的石灰水,并加以振荡,再观察石灰水发生什么变化(图 3-7)。
【问题讨论】
-
木炭在氧气里燃烧和在空气里燃烧有什么不同?为什么?
-
木炭在氧气里燃烧有什么物质产生?用什么实验可以验证?
木炭(主要成分是碳)在氧气里燃烧比在空气里燃烧得更旺,同时发出白光并放出热量。
木炭跟氧气的反应,可用文字式表示如下:
碳+氧气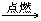 二氧化碳C
O2 CO2
二氧化碳C
O2 CO2
【观察与思考】
在燃烧匙里放少量硫粉,在酒精灯上点燃,注意观察硫在空气里燃烧时的现象,然后再把燃着的硫连同燃烧匙伸进盛有氧气的集气瓶里,注意观察硫在氧气里燃烧时的现象(图 3-8)。
硫在氧气里燃烧比在空气中燃烧得更激烈,发出明亮的蓝紫色火焰,生成一种叫做二氧化硫的带有刺激性气味的无色气体,并放出热量。这个反应也可
用文字式表示如下:
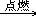 硫+氧气
二氧化硫S O2 SO2
硫+氧气
二氧化硫S O2 SO2
【问题讨论】
试想磷在氧气里燃烧与磷在空气中燃烧的现象会有什么差异?
【观察与思考】
铁丝也能燃烧吗?在什么条件下才能燃烧?铁丝燃烧是什么样的?
取一根无锈光洁的细铁丝,把它绕成螺旋状,一端系一根粗铁丝,另一端系上一小段火柴梗,手持粗铁丝,点燃火柴梗后连细铁丝一同伸进盛有氧气的集气瓶里(图 3-9),观察发生的现象(集气瓶内应预先装少量水或在瓶底铺上一薄层湿的细砂)。
【问题讨论】
-
为什么细铁丝一端要系上一小段火柴梗,并点燃后再伸进氧气瓶里?
-
细铁丝在氧气瓶里燃烧时,火星四射,生成的黑色固态物质(四氧化三铁)熔化而溅落瓶底,这些现象说明了什么?
-
本实验为什么要在集气瓶里预先装少量水或在瓶底先铺一薄层湿的细砂?
-
推测镁条在氧气里燃烧将会有什么现象(回忆过去镁条在空气里燃烧的实验)?
铁在氧气中燃烧的反应可用文字式表示如下:
铁+氧气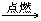 点燃四氧化三铁Fe
O2 Fe3O4
点燃四氧化三铁Fe
O2 Fe3O4
从上面一些实验可以看出:
-
物质在氧气中燃烧比在空气中燃烧剧烈,甚至有些在空气中一般不能燃烧的物质,却能在氧气中燃烧。
-
物质在氧气中燃烧时,一般都有大量的热放出。可见在化学反应中, 不仅有新物质生成,还伴随有能量的变化。
木炭、硫黄、磷、铁等物质在氧气里燃烧时,生成了相应的二氧化碳、二氧化硫、五氧化二磷、四氧化三铁。像这种由两种元素组成,其中一种是氧元素的化合物叫做氧化物。在上述这些反应中还有一个共同点,就是由两种物质起反应而生成另一种物质,我们把由两种或两种以上物质生成另一种物质的化学反应叫做化合反应。
【观察与思考】
氧气除了和碳、硫、磷、铁等单质反应外,还可以和哪些物质反应呢? 把燃烧匙里点燃着的一小段蜡烛伸进盛有氧气的集气瓶里,观察现象。
待燃烧停止并冷却后,仔细观察瓶壁上有什么现象?取出蜡烛,向瓶里倒进一些澄清的石灰水,振荡,观察石灰水有什么变化(图 3-10)?
【问题讨论】
蜡烛在氧气里燃烧是否也属于化合反应?为什么?
蜡烛(主要成分是由碳和氢两种元素组成的石蜡)在氧气里燃烧比在空气里燃烧得更旺,发出白光和放出热量,在冷的瓶壁上有水雾出现,产生的气体能使澄清的石灰水变浑浊,这说明石蜡与氧气反应除产生二氧化碳气体外还有水生成。所以这个反应不属于化合反应。
我们日常见到的煤、木材、汽油、酒精等物质在空气中燃烧,实质上也是跟空气中的氧气发生了化学反应。这些反应都是属于我们通常所说的氧化反应。氧化反应不一定都是化合反应。
综上所述,氧气不仅能跟多种非金属和多种金属反应,而且还能跟某些化合物反应,这些反应都放出热量,甚至剧烈地燃烧,可见氧气是一种化学性质比较活泼的气体。
氧气的用途
物质的用途是由物质的性质决定的。由于氧气具有易于跟其它物质发生反应并放出热量的性质,氧气在工农业生产和科学研究方面有着许多用途。供给呼吸和支持燃烧是氧气的重要用途,但在一般情况下只需空气就可以了,只有在特殊情况下,才需要使用纯氧,例如不能进行正常呼吸的病人, 常需要供给富氧空气;在低氧或缺氧环境中工作的人,如宇航员、高空飞行员、登山运动员、潜水员等都要携带供氧设备;氧炔焰可以用来焊接或切割金属;炼钢炉里鼓入富氧空气可以加速冶炼过程,提高钢的质量和产量;在国防工业和宇航工业上,液氧可用于制造液氧炸药和火箭燃料的助燃剂等。图 3-11 简要地表示出氧气的一些主要用途。
【选学】臭氧
在空气中还存在着一种极微量的气体叫臭氧,它的化学式为 O3,主要分布在距地面 10~15 千米的高空,形成一层臭氧层。
氧气在高压放电的条件下能转变成臭氧,它是化学性质比氧气更为活泼
的氧元素的另一种单质。

臭氧是一种浅蓝色有特殊臭味的气体,具有很强的氧化性和杀菌能力。只要臭氧的浓度达到百万分之 0.02(质量),人的鼻子就能觉察到它的
刺激性气味。有时我们在松树林里或雷雨过后,会觉得空气格外新鲜,就是因为这时空气中有一小部分的氧气转变成了臭氧。空气中含有极微量的臭氧,对人体健康是有益的。
臭氧层能大量吸收太阳光线中的紫外线,对地球上的生物起到保护作用。但是排放到空气中的一些有害物质(主要是氮的氧化物、氟氯烃等)能破坏臭氧层,据统计,臭氧在大气中的含量每减少 1%,太阳紫外线辐射到地面的量就增加 1.5%~2.0%,皮肤癌患者就可能增加 5%~7%。人类活动对臭氧层含量的影响已成为一个全球关注的问题。目前在南极上空已出现臭氧“空洞”,国际上正在积极研究,以防止臭氧层进一步遭到破坏。
