三、判断未知物,并写出有关反应式
 39.(1)NaNO2,
AgNO3,NH4Cl 或 NaNO2,AgNO3,FeCl3,NH4F (2)Ca(OH)2,CuCl2。
(3)NH4NO3+NaNO2 NaNO3+N2↑+2H2O
39.(1)NaNO2,
AgNO3,NH4Cl 或 NaNO2,AgNO3,FeCl3,NH4F (2)Ca(OH)2,CuCl2。
(3)NH4NO3+NaNO2 NaNO3+N2↑+2H2O
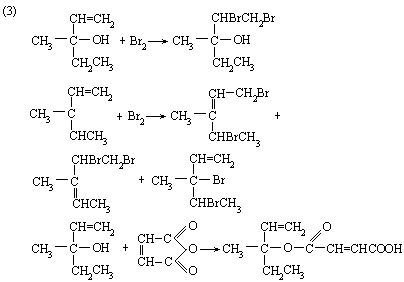 (4)5NO
− +2MnO− +6H + === 2Mn2+ +
5NO − +3H O
(4)5NO
− +2MnO− +6H + === 2Mn2+ +
5NO − +3H O
2 4 3 2
 40.
40.
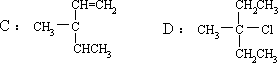
(2)B 有旋光性,C 无旋光性。
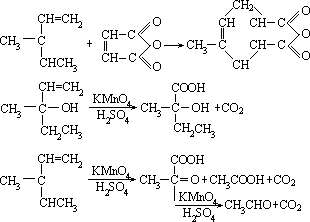
四
|
实验步骤 |
加入试剂 实验现象 |
可鉴定的离子 |
|---|---|---|
|
1 |
红色石蕊试纸 变蓝 HNO3 酸化至强酸性 有无色气体放出* CCl4 萃取 CCl4 层呈紫色 适量AgNO 溶液 白色沉淀 3 Na CO 中和至 pH ~ 7 黄色沉淀 2 3 再加AgNO3 溶液 |
OH− CO2- 3 − I C − l PO3− 4 |
|
2 |
||
|
3 |
||
|
4 |
||
|
5 |
*溶液变黄或棕色,这是 −被氧化析出 之故。
41.五、
42.(1)、M=WRT/(PV)=0.0267×8.31×460/(1.01×0.378)= 267 克/
摩。
(2)化合物中含 A:267×0.2= 53.4 克/摩,含 B:267×0.8=213.6
克/摩。
 推证
B 元素。B 可能是
Na(3s1),Al(3s23p1),Cl(3s23p5),Sc(3d1
4s2)。
推证
B 元素。B 可能是
Na(3s1),Al(3s23p1),Cl(3s23p5),Sc(3d1
4s2)。
元素是氯。
推证 A 元素。化合物的一个分子中含 A 元素原子的质子数之和为: 128−17×6=26 个。它可能是 Fe,那么分子式将为 FeCl6,但 Fe 的原子量为 56,与化合物分子中含 A 的相对质量 53.4 不相符,因此 A 不是 Fe。它可能是 2 个 Al 原子,并且原子量之和 27×2=54,与上述 53. 4 颇为一致。
由上分析,可得化合物分子式为:A12C16。
(3)结构式:
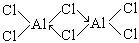
六、
43.设加入氨水的烧杯中 Ag+浓度为[Ag+]2,未加入氨水的烧杯中 Ag+浓度为[Ag+]1,则
0.254 = E∅ + 0.0591lg[Ag+ ] − E∅ − 0.0591 lg[Ag + ]
1 1 1 2
[Ag + ]
= 0.0591lg 1
[Ag+ ]
2
[Ag+]1/[Ag+]2=19852 (1)
[Ag+]1=50×0.0100/(50+50)=5.00×10−3mol·l−1
代 入 (1) 式 , 得 : [Ag+]2=2.52×10−7mol·l−1
考虑 Ag(NH3)+2 的生成与解离平衡:
 Ag+
Ag+
- 2NH3 [Ag(NH3)2]+
开始 ni/mmol 50×0.01 50×0.1
 反应
ni/mmol −0.5 −1.0 +0.5
反应
ni/mmol −0.5 −1.0 +0.5
[Ag(NH3)2]+的解离常数 KD
[Ag+ ][ NH ]2
K = 3 = 5.38 × 10−8 mol·l−1
D [Ag(NH +
1991 年复赛试题
一、
- Cr 含量的计算
8H+ + 3Fe2+ + CrO2− === 3Fe3+ + Cr3+ + 4H O
4 2
8H+ + 5Fe2+ + MnO− === 5Fe 3+ + Mn2+ + 4H O
4 2
KMnO4 滴定的 Fe2+:
5×17.20×0.0200=1.72mmol
与CrO2− 反应的Fe2+ :
25.00×0. 100 - 1. 72 = 0. 78mmol
∴n = 1 ×0.78 = 0.26mmol(在150mg合金中)
CrO2- 3
在 1500mg 合 金 中 : mcr=0.26×10×52.00=135.2mg
Cr 的百分含量=135. 2/1500=9.013% (2)铜、银含量的计算。
600mg样品(1500mg× 200)中,定量析出铬、银、铜的耗电量:
300
Q=(2×14.5×60/96480)×0.90=0.01623F
=16.23mF 或 16.23 毫摩电子。
600mg 样品中 Cr3+定量析出需要的电量QCr=2.6mmol×3×600/1500=3.12mmol 电子600mg 样品中 Cu2+、Ag+定量析出需要的电量:
QCu+QAg=16.23−3.12=13.11mmol 电子
mCu+mAg=600−135.2×600/1500=545.9mg
设其中含铜 xmg,则含银(545. 9−x)mg。所以
2x
63.55
+ 545.9 − x = 13.11
107.9
求得:x=362.6mg
铜的百分含量=362.6/600=60.4%
银的百分含量=(545.9−362.6)/600=30.6% 二、
1.(1)式与(5)式相当,(2)式与(3)式相当。
- 因为υ+3 / υ−3 <1,所以氧的化学吸附为控制步骤。即(3)式或(2)
式为控制步骤。
-
从(1)式、(2)式可知,V2O5 从 SO2 中夺得了电子(变为
V+4),又把电子授予了 O2,本身氧化为 V+5。所以它起了传输电子的“电子泵”作用。
-
图示如下:
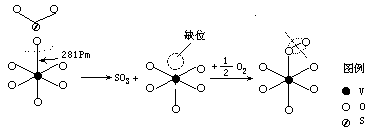
因为 V2O5 端基氧键长较长,最活泼,在反应物 SO2 的直接进攻时, 端基氧最易失去,而造成 V2O5 晶格的氧负离子缺位(同时 SO2 氧化为SO3)。由于氧负离子缺位的存在,使其易于吸附 O2 分子,O2 又把它氧化为 V+5。
三、
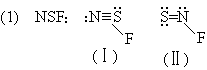
(Ⅰ)比(Ⅱ)稳定,(Ⅱ)尚未合成出来。
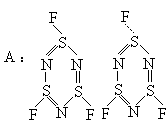
(Ⅲ)、(Ⅳ)互为异构体。
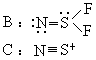
- A 中 S—N 键最长;C 中 S—N 键最短,皆由结构式可知。四、
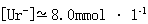 1.[Na+]=8.0mmol·1−1
[Ur−]+[HUr]=8.0mmol·1−1
1.[Na+]=8.0mmol·1−1
[Ur−]+[HUr]=8.0mmol·1−1
∴反应(2)的平衡常数为: K=1/([Na+][Ur−])=15625
2.脚趾、手指等处温度比体内低,尿酸钠溶解度较小,容易结晶, 使关节发炎。这说明温度下降,反应(2)K 增大;温度升高,K 减小。
降低温度使平衡向右移动,说明该反应是放热的。3.pH=5.4+1g([Ur−]/[HUr]) pH=7.4
当 HUr 沉淀时,[HUr]=0.5mmol·1−1,代入上式求得: [Ur−]=50mmol·l−1
1
[Na + ][ Ur − ] =
1
130 × 10−3 × 50 × 10−3 <K
所以不会出现 NaUr 结晶,即尿酸在血清中沉淀,与关节炎发作无关。4.当尿酸饱和时,[HUr]=0.50×10−3mol·l−1,[Ur−]=(2.0−0. 5)
× 10−3=1.50×10−3mol·1−1 5.病人和正常人排尿速率相对尿酸浓度是一级反应。因为根据排
尿实验,正常人和病人的半衰期都是恒定的值(40 小时)。半衰期为常数为一级反应的特征。
6.正常人 t1/2=40×60×60s k=ln2/t1/2=4.8×10−6s−1 病人 t1/2=40×60×60s
∴k=4.8×10−6s−1
因为他们排出尿酸的速率常数是相同的,因而可以结论:病人血液中尿酸含量过高不是肾排出尿酸减少(肾功能减退)所致,而是由于病人体内尿酸合成速率较高引起的。
五、
-
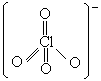 高氯酸根离子的
Lewis 结构式如右图所示。它的配位能力弱可归因于 Cl—O
键有较多的双键特征,中心 Cl+7
把离子表面的负电荷抽到氯原子上。
高氯酸根离子的
Lewis 结构式如右图所示。它的配位能力弱可归因于 Cl—O
键有较多的双键特征,中心 Cl+7
把离子表面的负电荷抽到氯原子上。 -
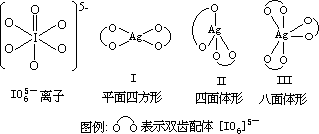 高碘酸根离子的
Lewis
结构如下图。它为八面体构型离子,它的空间位阻效应和螯合效应使它最适宜作为双齿配体,因此分子式可能是[Ag(IO6)2]7−,[Ag(IO6)3]12−,结构式如下图Ⅰ,Ⅱ,Ⅲ所示。
高碘酸根离子的
Lewis
结构如下图。它为八面体构型离子,它的空间位阻效应和螯合效应使它最适宜作为双齿配体,因此分子式可能是[Ag(IO6)2]7−,[Ag(IO6)3]12−,结构式如下图Ⅰ,Ⅱ,Ⅲ所示。
磁化率测定可以帮助确定其结构。若为平面四方形,则μ=0(d8 组态 Ag3+宜取 dsp2 杂化);若为四面体和八面体形,均有 2 个未成对电子, 为顺磁性。
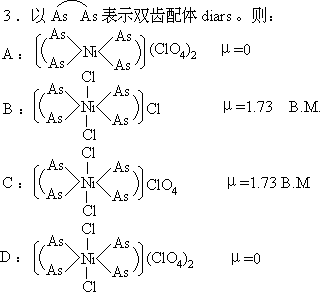
六、
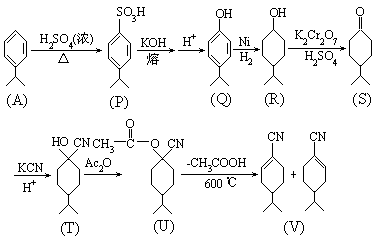 1
及 2 结构式如下:
1
及 2 结构式如下:
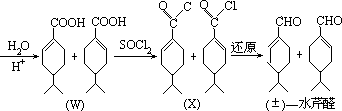
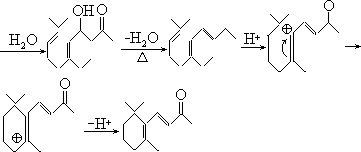
- 合成所得者为外消旋体,手征性出现在 U→V,双键可有机会相等的两种形成途径,从而造成外消旋体,而且一直维持到生成(±)一水芹醛。
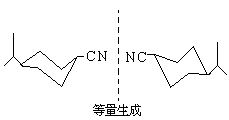
七、
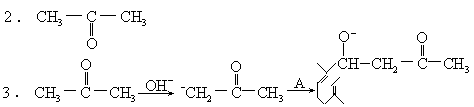 1.3,7−二甲基−2,6−辛二烯醛。
1.3,7−二甲基−2,6−辛二烯醛。
4.无手性。不是唯一产物,因为:
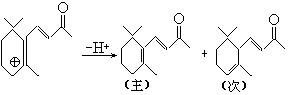
前者较后者共轭体系大,易生成。
