1989 年竞赛试题
(时限:150 分;满分:110 分)
原子量:H(1.0) He(4.0) N(14) S(32) O(16) Na(23) C(12) Cu(64) Ag(108)
第一、二大题都是选择题,每题各有一个或两个正确答案。全对者才给分。
一、选择题(每题 1 分,共 25 分) 1.下列变化中属于化学变化的是 [ ]
A.木材干馏 B.木炭使有色溶液褪色
C.金刚石变为石墨 D.CO2 变 为 干 冰2.关于离子晶体的性质,下列说法错误的是 [ ]
-
离子晶体的饱和水溶液都具有一定的导电性
-
所有高熔点物质都是离子晶体C.离子键没有方向性 D.离子键不具饱和性
- 将同温同压下的氦气和氮气按 1∶2 体积比混合,混合气体的平均分子量是 [ ]
A.30 B.32 C.20 D.21.3
- 下列物质中能使酚酞变红的是 [ ] A.NH4Cl B.Na2SiO3
- Fe(OH)3 D.Cu(OH)2·CuSO4
-
白铁与马口铁的镀层破损后 [ ]
- 白铁的铁腐蚀快 B.马口铁的铁腐蚀快C.一样快 D.无法比较
-
对于氧和臭氧,下列说法中正确的是 [ ]
- 同分异构体 B.同素异性体 C.同位素 D.以上说法都不正确
-
在溶液中能大量共存的离子组是 [ ] A.NH+4
Al3+ Cl− OH−
B.HSO− Na+ OH− NO−
C.NH+4 Fe3+ SO2− Cu2+
- Cu2+ SO2− I− K+
- 某元素 X 的最外层电子排布是 2s22p3,下列说法中错误的是
[ ]
- 该元素的氢化物在冰醋酸中是一种强碱B.其最高氧化物的分子式是 X2O5 C.其含氧酸的分子式是 H3XO4 D.含氧酸中存在分子内氢键
- 在澄清的石灰水中,通入下列过量气体,有浑浊产生的是
[ ]
A.CO2 B.NO2 C.HF D.H2S 10. 313K 时水的 Kω是 3.8× 10−14 。若在 313K 时[H+]=1.0 ×
10−7mol·L−1,溶液酸碱性是 [ ]
A.酸性 B.中性 C.碱性 D. 无 法 判 断 11.用同浓度 NaOH 滴定 pH 值和体积相同的氟硅酸(H2SiF6)和盐酸,
所用去的 NaOH 溶液的体积是 [ ] A.一样多 B.H2SiF6 比 HCl 多
C.HCl 比 H2SiF6 多 D.无法比较
12.室温下饱和 H2S 溶液中,离子浓度最小的是(已知 K1=9.1×10−8, K2=1.1×10−12) [ ]
A.HS− B.H+ C.OH− D.S2− 13.若某元素最外层电子排布是 7s27p1,该元素的原子序数是
[ ]
A.87 B.89 C.113 D.115
- A、B、C 三个电解槽,A 槽是 CuCl2 作电解液,纯铜片作阴极;B, C 两槽以 AgNO3 作电解液,纯银丝作阴极。先将 A,B 槽并联,再与 C 槽串联进行电解。若 B 槽中银丝增重 0.108 克,C 槽银丝增重 0.216 克,A槽中铜片增重是 [ ]
A.0.216 克 B.0.108 克
C.0.064 克 D.0.032 克15.下列各对物质中,相互间作用力最弱的是 [ ]
A.Ne+H2 B.H2O+O2
C.Ne+He D.H2O+HF
- 下列几种弱酸中,电离常数的大小顺序是 [ ]
①CH3COOH ②ClCH2COOH ③Cl2CHCOOH ④Cl3CCOOH
A.①>②>③>④ B.②>①>③>④ C.④>③>②>① D.③>④>②>①
- 把 pH=3 的盐酸溶液和 pH=9 的 KOH 溶液混合,使成 pH=7 的溶液,则 pH=3
和 pH=9 溶液的体积比为 [ ]
A.1∶100 B.100∶1 C.1∶100000 D.100000∶1 E.1∶3
- 下列反应中,属于非氧化还原反应的是 [ ] A.5Cl2+I2+6H2O=2HIO3+10HCl
B.IF5+3H2O=HIO3+5HF C.2F2+2NaOH=2NaF+OF2+H2O
D.2CCl4+K2Cr2O7+H2SO4(浓)=2COCl2+2CrO2Cl2+K2SO4+H2O
- 三种金属元素 A、B、C。A 不与热水反应,但在高温时与水蒸气反应产生
H2;B 的硝酸盐加热分解成单质 B,并有红棕色气体生成;C 的碳酸盐受热不易分解,其硝酸盐分解时不生成红棕色气体。这三种金属
|
的活动性是 |
[ | ] | |
|---|---|---|---|
|
A.A>B>C |
B.C>B>A |
||
|
C.C>A>B |
D.B>A>C |
||
|
20.下列说法错误的是 |
[ | ] |
A.H2 在化学反应中只能作还原剂B.H2O2 在化学反应中只能作氧化剂C.浓硫酸可作催化剂 D.石墨可作润滑剂
-
下列叙述中,正确的是 [ ] A.阴阳离子通过静电作用形成的化学键叫离子键 B.卤化银均难溶于水,且其溶解度随分子量的增大而减小C.碱金属的熔点随原子量的增大而降低 D.活化分子所具有的能量叫活化能
-
某元素原子的质量数 A=1,中子数 N=0,它与 A=3,N=2 的原子是 [ ]
A.互为同位素 B.互为同素异性体C.是两种不同的元素
D.两者的中性原子核外有相同电子数 23.下列说法正确的是 [ ]
- 全部含碳的化合物都是有机化合物B.环丙烷是乙烷的同系物 C.石棉和有机玻璃都是有机化合物D.石蜡和石膏都是有机化合物 E.石炭酸不是羧酸
-
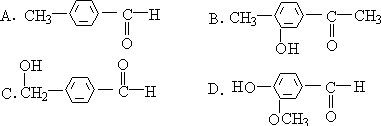 能与
FeCl3 显紫色,又能起银镜反应的物质是 [ ]
能与
FeCl3 显紫色,又能起银镜反应的物质是 [ ] -
下列说法正确的有 [ ]
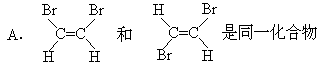
- 凡含有羟基的有机化合物都是醇或酚类C.葡萄糖只具有醛的性质 D.溴乙烷中的溴可被氰基(CN)取代
二、选择题(每题 2 分,共 10 分)
- 体积为 Vdm3 的 0.1mol·dm−3 苯甲酸溶液,要使电离度增加 0.5 倍,应将原溶液稀释到 [ ]
A.1.5V B.3V C.2.25V D.6V
- 同温同压下氧气与氢气的扩散速度之比是 1∶4,那么氦气与二氧化硫气体的扩散速度之比是 [ ]
A.1∶4 B.4∶1 C.16∶1 D.8∶1 3.久放的 NaOH 常吸收空气中的 CO2 而生成部分 Na2CO3 称取这样的
试样 W 克,溶解后加酚酞指示剂,用浓度为 Cmol·dm−3HCl 标准溶液滴定至红色刚消失,用去 HClV1dm3;然后加甲基橙指示剂,继续用 HCl 滴定至橙红色,又用去 HClV2dm3。该试样中 Na2CO3 的百分含量是 [ ]
A. C × V2 × (106 / 2) × 100%
W
C. C × 2V2 × 106 × 100%
W
B. C × 2V2 × (106 / 2) × 100%
W
C. C(V1 − V2 ) × 106 × 100%
W
 4.反应
Mg2++2OH− Mg(OH)2(s)的平衡常数
K=8.3×1010,Mg(OH)2 饱和溶液的[OH]是 [ ]
4.反应
Mg2++2OH− Mg(OH)2(s)的平衡常数
K=8.3×1010,Mg(OH)2 饱和溶液的[OH]是 [ ]
A.2.8×10−4mol·L−1 B.2.3×10−4mol·L−1 C.4.6×10−4mol·L−1 D.4.8×10−6mol·L−1
5.将 0.2molNO2,0.1molCO2,0.5molHCl 气体分别依次通入含 0.4mol
NaOH 的溶液中,最后所得的尾气的主要成分是 [ ] A.NO、CO2 B.NO2、CO2
C.NO、CO2、HCl D.NO2、NO、CO2
三、填空题(共 16 分)
-
将 5.040 克某二元有机酸晶体(无水化学式量为 72)制成 1dm3 水溶液。25cm3 此溶液需与 19.97cm30.1mol·dm−3 的 NaOH 溶液完全反应。则可确定每摩该晶体酸中结晶水的量是 摩。
-
将 60cm3O2 通入 10cm3
某气体烃中,点火燃烧并冷却后,得气体
体积为 50cm3,用 KOH 溶液吸收后尚余 30cm3。则此气态烃的分子式为
(室内状况)。 3.在绿色植物光合作用量子效率的测定中发现:每放出一个 O2 分子
要吸
ο
收8个6880A 的红光量子。光合作用中每释放1molO2
平均储能469kJ·mol -1。
那么,在此实验中能量转换效率是 。(已知 h=6.626×10−34J·S)。4 .以最小整数比配平下列反应方程式:[ ]RUS2+[ ]KClO3
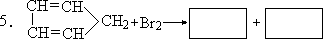 +[
]HCl=[ ]RuO4+[ ]RuCl3+[ ]H2S+[ ]S+[ ]KCl
+[
]HCl=[ ]RuO4+[ ]RuCl3+[ ]H2S+[ ]S+[ ]KCl
6.戊烷在光的照射下与氯起反应,生成有旋光性的一氯戊烷,该物质的结构式是 。
四、填空题(共 12 分)
把下列各步反应的有机产物结构式填入空格内:
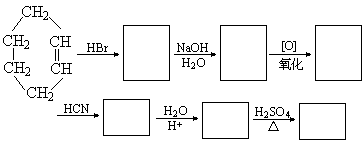
五、推理题(共 15 分)
-
Na2S 和 Na2CO3 以 2∶1 的摩尔比配成溶液,然后通入足量的 SO2, 可制得 Na2S2O3。试根据你所学的知识,推测上述反应分几步完成?按反应顺序写出各步的反应式,并写出总反应式。
-
某芳香烃分子式为 C9H12,用重铬酸钾和浓硫酸混合液氧化后可
得一种二元羧酸。将原芳烃硝化,只得两种一元硝化产物,试推导此芳烃的构造式,并写出各步反应式。
六、判断题(共 18 分)
现有九瓶白色固体药品,因瓶签脱落,需要进行鉴别。已知它们可能是:Na2SO4,Na2CO3,Na2SO3,BaCl2,MgSO4,Ba(NO3)2,KI,NaHCO3 , AgNO3,NH4Cl,Pb(NO3)2,Al2(SO4)3,NaOH。实验结果如下表所示:
|
编号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|---|---|---|---|---|---|---|---|---|---|
|
1 2 |
|||||||||
|
3 |
白↓ |
||||||||
|
4 |
白↓ |
||||||||
|
5 6 |
白↓且↑ |
||||||||
|
7 |
白↓ |
||||||||
|
8 |
白↓ |
△↑ |
白↓后溶 |
白↓后溶 |
|||||
|
9 |
黄↓ |
无现象 |
白↓ 后棕↓ |
表中横行与纵行的数字为未知药品的编号,表内示出了它们相互反应的现象。“白↓”表示有白色沉淀生成;“白↓且↑”表示有白色沉淀生成且有气体逸出;“△↑”表示加热时有气体逸出;“白↓后溶”表示最初生成的白色沉淀一摇动则溶解;“白↓后棕↓”表示生成的白色沉淀立即变为棕色沉淀;表中空格,表示没有进行实验。
由上述实验事实,可以判断出各编号药品是:
1.
4.
7.
2.
5.
8.
3.
6.
9.
七、计算题(14 分)
请先阅读以下的叙述,再解答后面提出的问题。
对于有气体参加的可逆反应,可以用各气体的平衡分压力代替平衡浓度来表示其平衡常数。用分压(以大气压为单位)表示的平衡常数叫做压力平衡常数,以 Kp 表示。例如反应:
 3Fe(固)+4H2O(气)
Fe3O4(固)+4H2(气)
3Fe(固)+4H2O(气)
Fe3O4(固)+4H2(气)
P4
H2
p 4
H2O
式中PH 和PH O 分别表示平衡时H 2 和H 2 O(气)的分压力,其指数与反应式中相应物质的系数相等。注意:Kp 表达式中不包括纯固体,纯液体的压力项,由于它们的蒸气压在一定温度下为定值,可以包含在平衡常数
Kp 内。
问题:将纯 H2S 通入放有固态 FeCl2 并已抽真空的密闭烧瓶内,加热烧瓶到 329.9℃,并恒温,四天之后假定已达到平衡。此时烧瓶中含有两种固体 FeCl2 和 FeS1+xo 气相中仅有 H2S,HCl 和 H2,其分压分别为 0.300, 0.803 和 0.0563 大气压。(1)求化学式 FeS1+x 中 x 的值;(2)写出烧瓶中所发生的平衡反应方程式(相对于 1 摩FeCl2 而言),并求出其 lgKp 值。(已知 lg0.300=−0.523,lg0.803=−0.0953,lg0.0563=−1.25)。
