1991 年竞赛试题
(时限:150 分;满分:140 分)
一、选择题(每题 2 分,共 60 分)
下列各题各有 1~2 个正确答案,全对者才得分。1.原子量有小数,最好的解释是 [ ]
A.由于电子的质量 B.由于同位素存在C.由于测定原子质量不够准确 D.由于有杂质 E.上述四条都有关
- 提供在原子中存在能级证据的是 [ ] A.原子序数 B.原子半径
C.质量亏损 D.光谱线E.电离能数据
- 在碱金属的焰色反应中,钠盐呈黄色是由于 [ ] A.钠被氧化的结果
B.钠发生离子化的结果 C.钠原子中的电子从高能级降到低能级的结果D.钠原子中电子从低能级升到高能级的结果E.钠离子中的电子跃迁的结果
- 下列各组离子中,可能大量存在于同一溶液中的一组离子是
[ ]
-
Cu2+,Al3+,Cl−,HCO−
-
Fe2+,K+,Cl−,I−
C.H+,K+,MnO− ,Cl− D.H+,Fe2+,Cl−,NO−
E.S2−,Na+,HS−,Cl−
- 在一定条件下,将 2molA,3molB 放在一密闭容器中反应:
 2A(气)+3B(气)
C(气),达平衡后测得 C 为 0.5mol。再通入 8molA,达新平衡后 C
的物质的量是 [ ]
2A(气)+3B(气)
C(气),达平衡后测得 C 为 0.5mol。再通入 8molA,达新平衡后 C
的物质的量是 [ ]
- 2mol B.小于 2mol,大于 1.5mol C.小于 1.5mol,大于 1mol
D.1mol E. 小 于 lmol, 大 于 0.5mol 6.物质的量相等的(NH4)2HPO4、(NH4)H2PO4、(NH4)3PO4 三种盐分别
与浓度相同的 NaOH 溶液完全反应时,消耗氢氧化钠溶液的体积比是
[ ]
A.1∶1∶1 B.1∶2∶3 C.2∶1∶3 D.3∶2∶3 E.1∶3∶2
- 假设 A 元素不存在同位素,An−阴离子的原子核内有 x 个中子,A 元素的质量数为 m,则 W 克 An−阴离子所含电子的物质的量是 [ ]
W(m − x − n)
A. m B.
W(m − x + n)
m
C. m − x + n
m ⋅ W
E.以上答案都不对
D. m − x − n
mW
 在一定温度下,密闭容器中的反应:N2(气)+3H2(气)
NH3(气) 达到平衡的标志是 [ ]
在一定温度下,密闭容器中的反应:N2(气)+3H2(气)
NH3(气) 达到平衡的标志是 [ ]
(式中υN 2 表示反应物N 2 的平均消耗反应速率,其余类推)
A.υN2 = υ NH3 B.3υN2 = υ H2
C.2υ N2
= υNH3
D.υN2 = 2υNH3
E.总压不随时间而变化
|
9.下列变化属于克服分子间力的是 |
[ | ] |
|---|---|---|
|
A.碘的升华 B.硫黄变为硫蒸汽 |
||
|
C.二硫化碳汽化 D.汞变成汞蒸汽 |
||
|
E.以上变化都是 |
||
|
10.下列叙述错误的是 |
[ | ] |
A.H3PO4 的酸性比 H3AsO4 强B.H3PO4 的氧化性比 H3AsO4 强
C.H3PO4 溶液中只含有 H+,H2PO− ,HPO2− ,PO3− 四种离子D.1molH3PO4 与 1mol NaOH 反应,其水溶液显酸性 E.H3PO4 的酸性比焦磷酸 H4P2O7 弱
- 某酸的 Ka=1×10−4,它与 NaOH 反应的平衡常数应为 [ ] A.1×10−4 B.1×10−10
C.1×1010 D.1×104
E.1×1018
- 下列元素中在自然界没有游离态存在的是 [ ]
A.C B.Si C.S D.P E.O 13.某学生配制 100 毫升 1 摩/升的 H2SO4 溶液,进行以下操作,然
后精确滴定,发现结果偏低。从他的操作中,可能使结果偏低的有
[ ]
-
量筒用蒸馏水洗净后即用来量取所需要的浓硫酸,再将浓 H2SO4 注入洗净的烧杯中
-
用少量蒸馏水多次冲洗量筒,洗液倒入上述烧杯中
-
将烧杯中的 H2SO4 沿玻棒全部移入 100 毫升的容量瓶内,烧杯用少量蒸馏水多次冲洗,洗液也倒入容量瓶内
-
加蒸馏水于容量瓶到接近标线 2~3 厘米处,盖紧玻塞,上下颠
倒摇匀
- 最后用胶头滴管加蒸馏水到标线,盖塞再次摇匀
14. 已知: C( 石墨 )+O2( 气 )=CO2( 气 )+393.7kJC( 金刚石 )+
O2(气)=CO2(气)+395.8kJ
则石墨转变为金刚石的反应热是 [ ] A.+789.5kJ B.−789.5kJ
C.+2.1kJ D.−2.1kJ E.0
- 用 NaHSO3 与酸反应制备 SO2 气体,最好选用下列酸中的
[ ]
- 浓 HCl B.稀 HCl C.浓 H2SO4 D.稀 H2SO4 E.HNO3
- 除去 CO2 中混有的 HCl 和 SO2 气体,最好选用下列试剂中的
[ ]
- 饱和碳酸钠溶液 B.饱和亚硫酸钠溶液
C.饱和小苏打溶液 D.饱和亚硫酸氢钠溶液E.品红溶液
-
在配离子中,配体(L)与金属离子(M)之间可发生 L→M
的电子跃迁。金属离子越易被还原,L→M 跃迁所需能量越小。光可提供跃迁的能量,下列离子发生 L→M 跃迁时,所吸收光的波长最长的是 [ ]
- VO 3−
D. MnO−
- CrO 2−
E. MnO2−
C.WO 2−
4 4
- 乙烷与丙烷混合气体完全燃烧得 CO226.4 克和 H2O15.3
克,则混合气体中乙烷与丙烷物质的量之比为 [ ]
A.1∶1 B.1∶2 C.2∶1
D.2∶3 E.3∶2
-
将锌粉加入到含有 FeCl3 和 CuCl2
的溶液中,反应完成后,容器底部有金属粉末存在,同时溶液里有较多的 Fe2+,则下列叙述中正确的是 [ ]
- 金属粉末肯定有 FeB.金属粉末肯定有 Cu
C.金属粉末肯定有 Zn D.溶液中可能有较多的 Cu2+ E.溶液中 Cu2+浓度可以忽略不计
-
下列 0.1 摩/升的盐溶液的 pH 值由大到小排列正确的是[ ]
- NaHCO3>CH3COONa>C6H5ONa>Na2CO3
B.Na2CO3>C6H5ONa>CH3COONa>NaHCO3
- NaHCO3>CH3COONa>C6H5ONa>Na2CO3
C.Na2CO3>C6H5ONa>NaHCO3>CH3COONa D.CH3COONa>NaHCO3>C6H5ONa>Na2CO3 E.Na2CO3>NaHCO3>C6H5ONa>CH3COONa
- 下列化合物中,键角最小的是 [ ] A.Cl2O B.ClO2 C.OF2
D.XeF E.ICl−
-
下列化合物中,具有顺磁性的是 [ ] A.Cl2O B.ClO2 C.OF2
D.[Cu(NH3)4]2+ E.[Ag(NH3)2]+
-
能与碳酸氢钠溶液在一定条件下反应,又能使酸性高锰酸钾溶液和溴水褪色的物质是
[ ]
- 葡萄糖 B.对甲基苯酚 C.茶油D.丙烯醛 E.丙烯酸甲酯
-
下列物质互为同系物的是 [ ] A.软脂酸与油酸 B.苯与萘
 C. OH与
C. OH与
CH2OH
D.硬脂酸甘油酯与乙酸乙酯E.以上都不是
- 下列化合物中,既显酸性,又能发生分子内酯化反应和消除反应的是 [ ]
Br
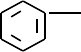 CH—
COOH
CH—
COOH
— CH2OH
Br
 CH—
CH—
CH2COOH
— OH
- 3−羟基丁酸 D.2−羟基丙酸E.2−羟基丙酸丙酯
- 某有机物(1)有银镜反应;(2)与 NaOH 溶液共煮可溶解;(3)加Na2CO3
溶液无气体放出;(4)在一定条件下使溴水褪色。根据以上实验事实,则该有机物可能是 [ ]
A.HCOOH B.CH2=CH−COOCH3
C.HCOOCH=CH2
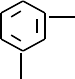 D.
COOH
D.
COOH
CH=CH2
E. 核 糖 27.某烃的一卤代物有四种同分异构体,则此烃可能是 [ ]
A.甲苯 B.二甲苯 C.乙苯D.C4H10 E.α−甲基萘
- 在下列物质中加入浓 H2SO4 加热没有反应的是 [ ] A.萘 B.蔗糖 C.甲醇
D.环己烷 E.脲素
- 下列化合物中,硝化反应时硝基进入氯原子的邻位的化合物是
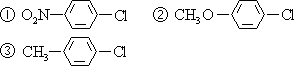 [
]
[
]
A.① B.② C.③ D.①和③ E.①②③ 30.某有机物的氧化产物 A,还原产物 B,B 只能生成一种一溴代物
C。C 与镁反应后,可与 A 反应生成一个 C4 化合物,该有机物是 [ ] A.乙烯 B.乙醛 C.乙醇
D.乙酸 E.乙烷
二、填空题(共 24 分)
-
 Hg2++Hg
Hg2+2 的平衡常数为 66。取稀 HNO3
与过量汞作用,当反应达到平衡时,Hg2+2 浓度为
0.1mol·L−1,则 Hg2+浓度为
mol·L−1。若 Hg 与过量稀 HNO3 作用,当
Hg2+浓度为 0.1mol·L−1 时,则 Hg2+2
浓度为 mol·L−1。
Hg2++Hg
Hg2+2 的平衡常数为 66。取稀 HNO3
与过量汞作用,当反应达到平衡时,Hg2+2 浓度为
0.1mol·L−1,则 Hg2+浓度为
mol·L−1。若 Hg 与过量稀 HNO3 作用,当
Hg2+浓度为 0.1mol·L−1 时,则 Hg2+2
浓度为 mol·L−1。 -
某金属 M 与 HNO3 作用生成含氧酸 H2MO4,H2MO4 不溶于水,加热
干燥后得 MO3。取 M 与 Ag、Au 的合金 W1 克(其中含 AgW2 克,AuW3 克)与
HNO3 完全作用,再过滤洗涤,将不溶物加热、干燥、称重得 W4 克。则金
属 M 的摩尔质量为 克/摩。
- 气态氯原子与一个电子结合比气态氟原子与一个电子结合放出
更多的能量,这是由于 。
-
将装有压缩 CO2 气体的钢瓶阀突然打开,可得到干冰(固体),这是 由 于 。
-
某蛋白质水解得一溶于水的固体化合物 A,A 在电场中因 pH 不
同分别移向阴极和阳极。A 无旋光性,加热得一固体化合物 B,其摩尔质量为 114 克/摩,则 A 的结构简式是 。B 的结构简式是 。
-
将一试管 NO2 和 O2 的混合气体,倒置于盛水的水槽中,水面能升至试管体积的四分之三,则混合气体中 NO2 与 O2 体积比是 。
-
有人设计以 Pt 和 Zn 为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠人体内体液中含有一定浓度的溶解氧, H+和 Zn2+进行工作。
- 请写出正极反应和负极反应的方程式: 正极: ;
负极: 。
- 若该电池在 0.8 伏,40 微瓦条件下工作,则工作电流为 A。(3)将 5 克 Zn
埋入人体内,则可以维持 年才需要进行第二次手
术更换。(每摩电子电量为 96500 库)。
- 肼(N2H4)可用作火箭的推进燃料,在 K3[Cu(CN)4]催化剂存在下,与 H2O2 水溶液反应。配平的反应式是:
N2H4+H2O2→
后来改用液氧或 N2O4 氧化不对称二甲基肼和有机混合物的方法配平的反应式是:
(CH3)2NNH2+N2O4→
三、判断未知物,并写出有关方程式(本题共 24 分)
- 有一固体混合物,可能含有 FeCl3、NaNO2、Ca(OH)2、AgNO3、CuCl2 、 NH4F 和 NH4Cl 七种物质中的若干种。若将此混合物加水后,可得白色沉淀和无色溶液。在此无色溶液中加入 KSCN 溶液没有颜色变化。将无色溶液加热有气体逸出。无色溶液可使酸化的 KMnO4 溶液褪色。白色沉淀可溶于氨水。根据以上事实,判断
(1)肯定存在的物质是: 。(2)肯定不存在的物质是: 。
(3)写出“加热无色溶液有气体放出”的反应方程式。 。 (4)写出“无色溶液使酸化的 KMnO4 溶液褪色”的离子反应式。
。
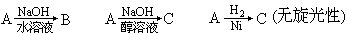 某卤代烃
A(C6H11Cl)有旋光性。A 可使酸性 KMnO4 溶液褪色。A
经下列变化得到化合物 B、C、D:
某卤代烃
A(C6H11Cl)有旋光性。A 可使酸性 KMnO4 溶液褪色。A
经下列变化得到化合物 B、C、D:
- 写出 A、B、C、D 的结构式。
A ;B ;C ;D 。
- B 和 C 是否有旋光性?
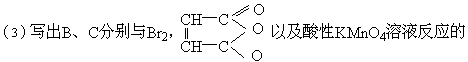
方程式(如可反应的话)。
四、鉴定题(10 分)
- 某溶液中含有Cl − ,OH− ,I−
,CO2− 和PO3− 五种阴离子。只允许取
3 4
一次该溶液,即能将五种阴离子一一鉴别出来。按你设计的鉴定顺序, 完成下列表格。
|
实验步骤 |
加入试剂 实验现象 可鉴定的离子 |
|---|---|
|
1 2 3 4 5 |
五、(本题共 12 分)
- 在 A、B 两元素组成的化合物中,B 的含量占80%。在460K,1.01kPa压力下测得该化合物蒸汽 378cm3 的质量是 0.0267 克。该化合物的每个分子中共含有 128 个质子。B 元素的原子 M 层上有一个未成对电子。试
(1)求此化合物的摩尔质量。(2)推导此化合物的分子式。(3)写出该化合物的结构式。六、(本题共 10 分)
- 已知某金属 M 浸入 Mn+溶液中,其电极电势 E
与[Mn+]有如下关系:

现设计如下实验:在两个烧杯中分别注入相同的混合溶液,即由50.0cm3 0.0100mol·dm−3 AgNO3 和 50.0cm30.100mol·dm−3NH4NO3 组成的混合溶液。将两根银电极用铜线相连,分别浸入到上述两烧杯的混合溶液中;两根相同的参比电极(电极电势为定值)通过电位计相连,也分别浸入到上述混合溶液中。现往其中一个烧杯中逐渐加入50.0cm30.100mol·dm−3 的氨水,生成[Ag(NH3)2]+。由电位计测得两参比电极间电势差为 0.254 伏特。据此求[Ag(NH3)2]+的解离常数。
