三、有关多重平衡的计算
1.解:pH=7.4
[H+]=10−7∶4=4.0×10−8moldm−3
[H+ ][ HCO− ]
3 = 4.30 × 10−7
[H 2 CO3 ]
[HCO− ]
∴ 3 =
4.30 × 10−7
= 10.75∶1
− 8
[H 2 CO3 ] 4.0 × 10
2.解:(1)K 1 =
[ H+ ][HS− ] [H 2S]
[H + ] ≈ [ HS− ]
[H+ ]2
0.1
K2 =
= 9.1 × 10−8
[H + ][S2− ]
[HS− ] =
[H + ] = 9.5 × 10−5 moldm −3
9.5 × 10−5[S2− ]
9.5 × 10−5
[S2−]≈K2=1.1×10−12moldm−3
(2)
[HS− ]
= K1 = 1
[H S] [H + ]
∴[ H+ ] = K
pH = − lg K = − lg 9.1 × 10−8 ≈ 7
K2 =
[H + ][S2− ]
[HS− ] =
9.1× 10−8 × [S2− ]
0.1
[S2− ] =
1.1 × 10−12
× 0.1
−
= 1.2 × 10−6 moldm −3
9.1 × 10 8
(3)pH=1 [H+]=0.1moldm−3
[H+ ]2[S2− ]
[ H 2S]
= K1 ⋅ K 2
(0.1) 2[S2− ] = ⋅
0.1
K1 K 2
[S2−]=9.1×10−8×1.1×10−12/0.1=1×10−18moldm−3 [S2−][Fe2+]=1×10−18×0.1=1×10−19<Ksp=3.7×10−10
无 FeS 沉淀生成
(4)
[H + ]2[S2− ] [H 2 S]
= 9.1 × 10−8 × 1.1× 10−12 = 1.0 × 10−20
[Cu2+ ][S2− ] = 8.5 × 10−45
[H + ]2
[Cu2+ ] =
1.0 × 10−21
8.5 × 10−45
= 1.2 × 1028
假设与浓 HCl 反应,[H+]≈12moldm−3 则[Cu2+]仅 1.2×10−21moldm−3
实际上 CuS 不溶于盐酸或稀硫酸,不能用来制取 H2S。
3.解:(1)[H2CO3]=10−1.47·Pco2
=10−1.47×10−3.54=10−5.01
[H+ ][ HCO− ]
3 = 10−6.4
[H 2 CO3 ] [H+]2=10−6.4×10−5.01 [H+]=10−5.7
∴ pH=5.7
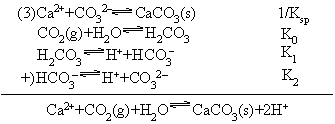 (2)同上,约为
5.7。
(2)同上,约为
5.7。
[H+ ]2
K = [Ca2+ ]Pco
[H + ]2
[Ca 2+ ]Pco
= K 0 K1 K2
Ksp
[H + ]2 =
10−18.2
−
[Ca 2+ ]Pco
10 8.8 2
= 10−9.9[Ca 2+ ]Pco (4)由(3)得[H+]2=10−9.9[Ca2+]Pco2
[H+ ]2
∴[Ca 2+ ] =
10−9.9 Pco
(10−7 ) 2
= 10− 9.9 × 10− 3.54
[Ca2+]=10−0.56=0.28moldm−3
4.解:[H + ] =
= 4.5 × 10-3 × 2.5 × 10−10
= 1.06 × 10−6 moldm −3
pH≈6.0
 解:(1)反应后为
Mg(OH)2 的饱和溶液Mg(OH)2 Mg2++2OH−
[Mg2+][OH]2=Ksp=1.2×10−11
4[Mg2+]3=1.2×10−11
解:(1)反应后为
Mg(OH)2 的饱和溶液Mg(OH)2 Mg2++2OH−
[Mg2+][OH]2=Ksp=1.2×10−11
4[Mg2+]3=1.2×10−11
[Mg2+]3=3×10−12
[Mg2+]=1.4×10−4
[OH−]=2[Mg2+]=2.8×10−4moldm−3 POH=3.6
pH=14−3.6=10.4
使酚酞变红
- NH4Cl 可使 Mg(OH)2 溶解,使反应加快Mg+2NH4Cl=MgCl2+2NH3+H2
即 Mg+2H2O=Mg(OH)2+H2 Mg(OH)2+2NH4Cl=MgCl2+2NH3+2H2O
- Mg 的物质的量
与 0.02molNH4+ 作用生成 0.02molNH3 ,原液中 NH4+ 为 4 × 0.01=0.04mol,反应后为 0.04−0.02=0.02mol。
∴pH=pKb=9.26
- 其反应实为Mg2++2NH3+2H2O=Mg(OH)2(s)+2NH4+

 可看作是下面两个反应的耦合Mg2++2OH−
Mg(OH)2(s) 2NH3+2H2O 2NH4++2OH−
可看作是下面两个反应的耦合Mg2++2OH−
Mg(OH)2(s) 2NH3+2H2O 2NH4++2OH−
(K ) 2 (1.8 × 10−5) 2
∴K = b =
Ksp
1.2 × 10−11
= 27
- 解:(1)体系同时存在三个平衡,前两个平衡是主要的。2×(1)−(2)
得
Xe+XeF4=2XeF2 Kp=K2p1/Kp2
∴Kp(250℃)=72 Kp(400℃)=65
令PXeF
= 1atm PXeF
= 0.01atm
2 4
P2 XeF
K = 4
p Xe·p XeF
250℃时:PXe=1.4atm
400℃时:PXe=1.5atm Xe+F2=XeF2
平衡时 1.4 0 1
开始时 1.4+1 1 0
∴250℃: Xe/F2=2.4∶1 400℃ Xe/F2=2.5∶1
(2)(3)−(2)得
XeF4+F2=XeF6 K’p=Kp2/Kp2 250℃时 K’p=0.94
400℃时 K’p=0.018
所以从热力学角度看 250℃时有利,从动力学角度看 400℃时有利。
PXeF
6 = 0.94
PXeF ·pF
1
0.1P
2
∴P =
= 0.94
1
= 10.6atm
F2 0.1 × 0.94
(3)得 XeF4 时,既不是 Xe 过量,也不是 F2 过量。2XeF4=XeF2+XeF6
250℃时
400℃时
'' = 7.8×10-4
'' = 3.3×10-3
因为K'' 值在250℃与400℃时相差不大,故两者均可。
 7.解:(1)
Ag++nNH3 [Ag(NH3)n]+
7.解:(1)
Ag++nNH3 [Ag(NH3)n]+
[Ag(NH ) + ]
K = 3 n
(1)
稳 [Ag+ ][NH ]n
 Ag++Br−
AgBr(s)
Ag++Br−
AgBr(s)
[Ag+][Br−]=Ksp (2)
(1)×(2)
[Ag(NH ) + ]
3 n = K ·K = K
[ NH 3
]n sp 稳
K[ NH ]n
[Br− ] = 3
(3)
+
[Ag(NH3 ) ]
[Br−]、[NH3]、[Ag(NH3)n+]均指平衡时浓度,可近似计算如下。
设每份加入的 Br−浓度为[Br−]0,体积为 VBr−,因刚产生混浊,忽略产生 AgBr 的 Br−,所以
V −
[Br− ] = [Br− ]
- Br
V总
加入的 Ag+浓度为[Ag+]0,体积为 VAg+,因为[Ag(NH3)n]+稳定,离解部分可忽略,又由于刚产生混浊,生成 AgBr 而消耗的 Ag+也可忽略,所以
V +
[Ag(NH ) + ] = [Ag+ ] × Ag
V总
NH3 相对过量较多,故被配位的 NH3 可忽略,所以
VNH
[NH 3 ] = [NH 3 ]0 ×
总
将[Br−]、[NH3]、[Ag(NH3)n+]代入(3)式
[NH ]
[ Br − ] [Ag + ] V
V = Vn
·K·( 3 0 ) n/ 0 ·
0 Ag
Br −
NH3 V V V
1 4 4 4 4 4 4 总 4 4 2 4 4总 4 4 4 4 4 总 4 3
∴V− = Vn
- K'
为常数
Br NH 2
两边取对数
lgV −
= nlgVNH + lgK'
[NH ]
[Br− ] [Ag+ ] V
K' = K ·K
( 3 0 ) n / 0 ·
0 Ag
sp 稳 V V V
总 总 总
(2) n=2 lgK'=−2 时
K ·K ·[NH ] 2
V 2
10−2 = 总
[Br − ] ·[Ag+ ] ·V
0 0 Ag+
2
总
K ·K ·[NH ] 2
= sp 稳 3 0
[Br− ] ·[Ag+ ] V
0 0
10−2[ Br − ] [Ag+ ]
K =
Ag +
Ag
稳 sp [NH
3 ]0
10−2 × 0.010 × 0.010 × 20
= 4.1 × 10−13 × 4
= 1.2 × 107
8. 解 : [Ag(NH3)+]=6.3×103[Ag+][NH3] [Ag(NH3)2+]=1.6×107[Ag+][NH3]2 [Ag+]+[Ag(NH3)+]+[Ag(NH3)2+]=0.10
[Ag+][1+6.3×103×1.0×10−3+1.6×107×(1.0×10−3)2)=0.10 [Ag+](1+6.3+16)=0.10
[Ag +]= 0.10 =4.3×10−3 moldm −3
23.3
4.3 × 10−3
0.10
× 100% = 4.3%
[Ag(NH3)+]=6.3×103×4.3×10−3×10−3
=0.027moldm−3
0.027 ×100% = 27%
0.10
[Ag(NH3)2+]=1.6×107×4.3×10−3(1×10−3)2
=0.0688moldm−3
0.0688 ×100% = 68.8%
0.10
