六、计算题
C,D混合气体M = 6.90 − 5.40 ×22.4 = 40g·mol -1。C(或D)与灼热铜
0.84
粉反应的现象,说明它是O 2 。Mo2 ×
0.84 − 0.56
0.84
+ M × 0.56 = M, M = 44g·
D 0.84 D
mol−1。D(或 C)可能是 N2O 或 CO2。由于 A 难溶于水,故 A 不是硝酸盐, 也说明 D(或 C)不可能是 N2O;而只能是 CO2。
由 A 的热分解产物,可知它是碳酸盐:
M CO ∆→ 2M + CO ↑ 1 ↑n
= 0.56 = 0.025mol
2 3 2
+ 2 O 2
CO 2
22.4
n = 0.025×2 = 0.050mol M = 5.40 = 108g·mol -1
B B
∴ B 为 Ag,A 为 Ag2CO3
0.05
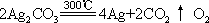
2.(1)根据无残存硫,判断生成了 0.095molSO2。(2)该 SO2 与 O2 反应,并达成平衡:
 2SO3
2SO2 + O2
2SO3
2SO2 + O2
平衡时 ni/mol: x, 0.095−x, 0.005
n 总=(0.095−x)+0.005+x=0.1(mol)
p2 ·p
( 0.095 − x
× 1) 2 (
0.005
× 1)
K, = SO2 o2 = 0.1 0.1
2
SO3
0.05 × 0.1 =
0.005
(0.095 − x)2
x2
x
( 0.1 × 1)
1 = 0.095 − x , x = 0.0475(mol) x
即nSO = 0.0475mol nSO
= 0.095 − 0.0475 = 0.0475(mol)
2 2
n = 0.005mol
2
对于第一个反应而言:p
× p = ( 0.0475 × 1)2
= 0.4752 ≈0.2256>
K
(1)
= 0.159
SO2
SO3
0.1
∴此时 FeSO4(s)不可能发生分解,残渣物为无水 FeSO4。1990 年复赛试题
|
一、 |
N2 |
+ |
3H2 = |
2NH3 |
|---|---|---|---|---|
|
一次平衡 c/mol·dm−3 |
1.0 |
0.50 |
0.50 |
|
|
重新平衡 c/mol·dm−3 |
1.1 |
x |
0.50−0.20=0.30 |
(0.50)2
∵KP = 1.0 × (0.50)3
(0.30) 2
∴2 = 1.1 × x3
= 2
x ≈ 0.34(mol·dm−3)
取走的 H2 为 (0.5+0.3−0.34)mol·dm−3×1dm3=0.46mol 二、(1)首先计算 KMnO4 溶液的浓度
 5C2O2−
5C2O2−
- 2MnO− +16H+ 10CO +2Mn2++8H O
5 2
25.00×0.0500 24.80x
x=0.02016mol·dm−3
- 然后计算亚铁离子物质的量
5Fe2++MnO− +8H+=Mn2++5Fe3++4H O
4 2
5 1
y 24.65×0.02016×10−3 y=2.485×10−3(mol)
- 最后计算 NH2OH 与 Fe(III)离子的物质的量之比:
nNH OH ∶n 3+
= 25.00×0.0494×10-3 ∶2.485×10-3 = 1∶2
 即每摩的
NH2OH 应得到两摩电子,所以 N−1→N+1,氧化产物是
N2O。反应方程式:
即每摩的
NH2OH 应得到两摩电子,所以 N−1→N+1,氧化产物是
N2O。反应方程式:
2NH2OH+2Fe2(SO4)3 N2O↑+4FeSO4+2H2SO4+H2O
 或
2HN2ON+4Fe3+ N2O↑4Fe2++4H++H2O
或
2HN2ON+4Fe3+ N2O↑4Fe2++4H++H2O
三 、 1.干法:
Ru∶S∶H O = 60.06 ∶ 37.26 ∶
2 101.1 32.06
2.73
18.00
为 RuS2
湿法:
=0.5941∶1.162∶0.151
=1∶1.96∶0.26 考虑硫化物的微量吸湿性,所以化学式
Ru∶S∶H O = 41.84 ∶
20.63 ∶ 37.36
2 101.1
32..06 18.00
=0.4138∶0.6435∶2.076
=2∶3.11∶10.03
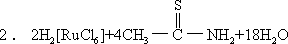 考虑到硫化物的微量吸湿性,所以化学式为
Ru2S3·10H2O
考虑到硫化物的微量吸湿性,所以化学式为
Ru2S3·10H2O
=Ru2S3·10H2O↓+4CH3COOH+4NH4Cl+S↓+8HCl
-
湿法制得的硫化物含硫结果偏高,这是由于它吸附硫,未完全洗净的缘故。
-
干法制得的硫化物对氢作用更稳定。
-
有两个脱硫峰说明有两种硫化物,即为 RuS·RuS2,所以氢还原过程:第一步,约 200℃以前脱去结晶水;第二步,~200—360℃ RuS+H2
→Ru+H2S;第三步,360—550℃,RuS2+2H2→Ru+2H2S 6.湿法制得的硫化物的第一个脱硫峰产生的新生态钌,可能对第二
个脱硫峰的脱硫过程具催化作用。
四、
- 在一个氯化钠晶胞中含有 4 个 Na+和 4 个 Cl−,即 4 个 NaCl 单元,
因此 FexO 晶胞中亦含有 4 个 FexO 单元。一摩 FexO 晶胞的质量为: 4×(55.85x+16)g=6.02×1023×(428×10−10)3×5.71g
x=0.92
- Fe0.92O,根据正负化合价相等的原则,设化学式中 Fe(II)为 y, 则
Fe(III)为 0.92−y,
(0.92−y)×3+y×2=2,y=0.76
0.76
Fe(II)占Fe总量% = 0.92 ×100% = 82.6%
0.92 - 0.76
Fe(III)占Fe总量% =
0.92
×100% = 17.4%
- FexO的化学式:Fe Ⅱ Fe Ⅲ O
0.76 0.16
-
O2−取立方密堆积, Fe(II)和
Fe(III)占据八面体空隙,只占全部八面体空隙的 92%,尚有 8%是缺限。
-
Fe - Fe之间的最短距离: 428 ×
2
= 302.6(pm)
五、
1.(1)87 Rb →37 Sr +0 e
37 38 −1
(2) 238 U →206
Pb + 84 He + 60 e
92 82
2 −1
2. N 0
N
= eλ' ,2.301g N 0
N
= λt
(1)
当 N 0
N
∴λ =
= 2,t = t
0.693
t 1
2
1 ,0.693 = λt 1
2 2
(2)
将(2) 式代入(1)式得:2.30lg N 0
N
当核反应(1)87Sr/87Rb=0.041,
= 0.693t
t 1
2
(3)
(87Sr+87Rb)/87Rb=1.041,即 N0/N=1.041
0.693t
代入(3)式,2.301g1.041 = (5.7 × 1010 ) ,
求得 t=3.3×109 年
同理,根据核反应(2), 206Pb / 238 U = 0.66 N / N = 1.66,
0.693t
2.30lg1.66 = 4.5 × 109
,t=3.3×109 年
由此可见,月球岩石年龄为 3.3×109 年。3.(略)
六、
七、
1991 年竞赛试题
